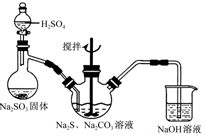
题目内容
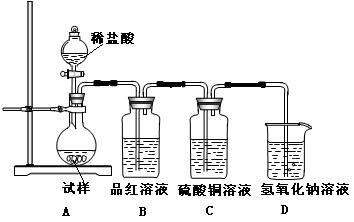
某同学拟定了以下实验方案,来确定一批合金废料的成分并加以回收利用。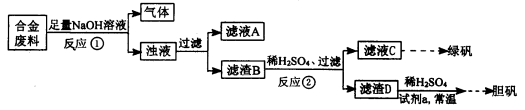
请回答下列问题:
(1)从上述信息可确定该合金中一定含有Fe和____(填化学式)。
(2)“试剂a”是一种不引入杂质的绿色氧化剂,该氧化剂的化学式为____;滤渣D、稀硫酸和试剂a总反应的化学方程式为 。
(3)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是:取少量滤液A于试管中,滴加 。
Na2SiO3溶液与过量的CO2反应的离子方程式为 。
(4)取质量均为13.2g的滤渣B四份,分别加入相同浓度,不同体积的稀HNO3充分反应,标准状况下所生成的NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | ① | ② | ③ | ④ |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L,标况) | 1.12 | 2.24 | 3.36 | 4.48 |
②滤渣B中Fe的质量分数为____%(精确到0.1%)。
(1)Cu(1分)(2)H2O2(或O3)(1分)Cu+H2O2+H2SO4=CuSO4+2H2O
(2分)(3) 逐滴滴加稀盐酸(或稀硫酸)至过量(1分),若先有白色沉淀(1分),然后沉淀完全溶解(1分)SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-(2分)
(4)①3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O(2分)②63.6%(2分)
解析试题分析:(1)结合产物判断流程中生成蓝矾,说明B中含有铜,即该合金中一定含有Fe和Cu。
(2)双氧水(或臭氧)是一种常见的绿色氧化剂,在双氧水的作用下,金属铜在硫酸中被氧化生成硫酸铜,发生反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O或Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O。
(3)由于偏铝酸钠与硅酸钠均与酸反应生成白色沉淀,但偏铝酸钠生成的氢氧化铝是两性氢氧化物可以溶解在酸中。但硅酸钠生成的硅酸不能溶解在酸中,据此可以鉴别二者。则验证滤液A只含NaAlO2、不含Na2SiO3的方法是取少量滤液A于试管中,滴加盐酸,开始生成白色沉淀为氢氧化铝,继续滴加盐酸,氢氧化铝会溶解生成氯化铝,无白色沉淀现象证明不含硅酸钠;碳酸酸性大于硅酸,因此过量二氧化碳通入硅酸钠溶液中,反应生成硅酸沉淀和碳酸氢钠,反应的离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-。
(4)①由于铁的还原性大于铜,所以铁首先与硝酸发生氧化还原反应,因此实验①中发生反应的化学方程式为3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O。
②由①、②两组数据分析,①组实验中金属过量,硝酸不足。①中溶解金属的质量=13.2g-9.0g=4.2g,此时生成1.12LNO气体,物质的量=1.12L÷22.4L/mol=0.05mol(转移0.05mol×3=0.15 mol电子)。由于金属有剩余,则生成的应该是亚铁离子。若只溶解铁,则铁的物质的量=0.15mol÷2=0.075mol,质量为0.075mol×56g/mol=4.2gg。若只溶解铜,铜的物质的量=0.15mol÷2=0.075mol,质量为0.075mol×64g/mol=4.8g。由此可知,实验①中恰好溶解了4.2g金属铁。根据实验②可知,②比①又多溶解了9.0g-4.8g=4.2g金属,而②比①多生成了2.24L-1.21L=1.12LNO气体,这说明实验②中共恰好溶解了8.4g金属铁。而根据③比②多生成了3.36L-2.24L=1.12LNO气体可知,剩余的4.8g金属全部是Cu。实验④比③又多生成了1.12LNO,这是由于发生了反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。由此可知滤渣中铁的质量分数=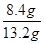 ×100%=63.6%。
×100%=63.6%。
考点:考查物质定量测定的实验方法应用以及氧化还原反应的有关判断和计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
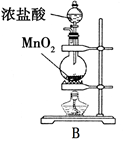
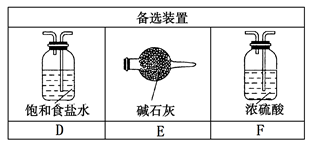
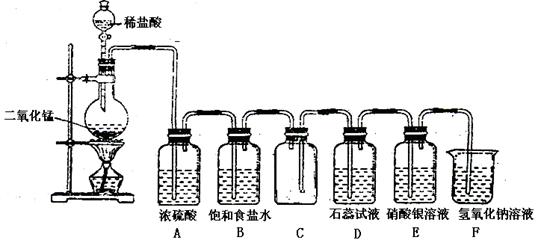
小学生10分钟应用题系列答案下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为 ;
装置B中饱和食盐水的作用是_________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 ;
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 ;
| | a | b | c | d |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__________色,说明 ;
打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 ;
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式 ;
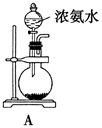
高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。
相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
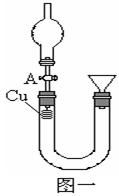
(1)仪器e的名称为____________,装置A中f管的作用是_______________________________________,其中发生反应的离子方程式为_____ ____________________________________ _______。
(2)装置B中的试剂是____________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
| 方案 | 不足之处 |
| 甲 | |
| 乙 | |
(4)在上述(3)的评价基础上,请设计一个合理方案:___________ ________ 。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。