题目内容
12.干电池是日常生活中应用非常广发的小型电池,锌和二氧化锰是制造干电池的主要原料,某电池厂的科研人员利用闪锌矿(主要成分是ZnS,另含少量CuFeS2和 SiO2)和铁锰矿(主要成分是MnO2,另含少量Al2O3和SiO2),设计如图所示的工艺流程生成锌和二氧化锰,并获得一系列的副产品(物质中所含的水均省略):试回答下列问题:

(1)CuFeS2中Fe元素的化合价为+2.
(2)已知滤液A中含有Zn2+、Mn2+、Cu2+、Fe3+和Al3+等阳离子.则在“酸浸”矿石粉的过程中,所得的还原产物是Mn2+(填离子符号,下同):在滤液A的:“除铜”过程中,与Cu2+一并被锌还原的金属阳离子是Fe3+.
(3)在滤液“B”的氧化过程中,离子方程式是MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O.
加入试剂乙是为了调节溶液的pH,试剂乙可能是BC(填序号).
A.Ba(OH)2B.ZnOC.MnCO3D.Cu2(OH)2CO3
(4)在滤液C的“电解”过程中阴极的离子方程式是Mn2++2H2O-2e-═MnO2+4H+;若“酸浸”时所加入的试剂甲为盐酸,则电解所得阳极产物是Cl2.
(5)在滤液D的“沉铝”过程中,化学方程式为NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3.
(6)该工艺生成流程的优点很多,如:热能耗低、不产生污染性气体、获得的副产品多.此外还有一个最显著的优点是:产品Zn、MnO2都可以循环利用.
分析 闪锌矿(主要成分是ZnS,另含少量CnFeS2和 SiO2)和铁锰矿(主要成分是MnO2,另含少量Al2O3和SiO2)粉碎,酸浸,过滤,滤液A中含有Zn2+、Mn2+、Cu2+、Fe3+和Al3+等阳离子,滤液中加少量Zn除Cu,Cu2+被还原为Cu,同时Fe3+被还原为Fe2+,过滤,滤液B中主要含有Zn2+、Mn2+、Fe2+和Al3+等阳离子,滤液B中加二氧化锰把亚铁离子氧化为铁离子,加ZnO或MnCO3调解pH,Fe3+和Al3+转化为氢氧化物沉淀,过滤,滤渣为氢氧化铁和氢氧化铝,加氢氧化钠,氢氧化铝溶解转化为偏铝酸钠,氢氧化铁不溶解,过滤,滤渣为氢氧化铁,滤液D中通过量的二氧化碳生成氢氧化铝沉淀,过滤得到氢氧化铝,滤液C中含有Zn2+、Mn2+,电解该溶液得到Zn和二氧化锰;
(1)CuFeS2中Cu为+2价,S为-2价,根据化合价的代数和为零计算;
(2)铁锰矿中含有MnO2酸浸后溶液中为Mn2+,Mn元素的化合价降低;氧化性:Cu2+<Fe3+;
(3)滤液B中加二氧化锰把亚铁离子氧化为铁离子;调节pH时加如的物质能消耗氢离子,但是不能引入新的杂质;
(4)滤液C中含有Zn2+、Mn2+,电解时阴极上锰离子得电子生成二氧化锰;阳极氯离子失电子生成氯气;
(5)偏铝酸钠溶液中通入二氧化碳生成碳酸氢钠和氢氧化铝沉淀;
(6)滤液C电解得到Zn、MnO2,分离过程中用到Zn、MnO2.
解答 解:闪锌矿(主要成分是ZnS,另含少量CnFeS2和 SiO2)和铁锰矿(主要成分是MnO2,另含少量Al2O3和SiO2)粉碎,酸浸,过滤,滤液A中含有Zn2+、Mn2+、Cu2+、Fe3+和Al3+等阳离子,滤液中加少量Zn除Cu,Cu2+被还原为Cu,同时Fe3+被还原为Fe2+,过滤,滤液B中主要含有Zn2+、Mn2+、Fe2+和Al3+等阳离子,滤液B中加二氧化锰把亚铁离子氧化为铁离子,加ZnO或MnCO3调解pH,Fe3+和Al3+转化为氢氧化物沉淀,过滤,滤渣为氢氧化铁和氢氧化铝,加氢氧化钠,氢氧化铝溶解转化为偏铝酸钠,氢氧化铁不溶解,过滤,滤渣为氢氧化铁,滤液D中通过量的二氧化碳生成氢氧化铝沉淀,过滤得到氢氧化铝,滤液C中含有Zn2+、Mn2+,电解该溶液得到Zn和二氧化锰;
(1)CuFeS2中Cu为+2价,S为-2价,根据化合价的代数和为零可知Fe的化合价为:+2价;
故答案为:+2;
(2)铁锰矿中含有MnO2酸浸后溶液中为Mn2+,Mn元素的化合价降低,则MnO2被还原.还原产物为Mn2+;已知氧化性:Cu2+<Fe3+,则加入Zn还原是先与
Fe3+反应生成Fe2+,再与置换铜离子得到Cu;
故答案为:Mn2+;Fe3+;
(3)滤液B中加二氧化锰把亚铁离子氧化为铁离子,其反应的离子方程式为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;调节pH时加如的物质能消耗氢离子,但是不能引入新的杂质,由于溶液中含有Zn2+、Mn2+,所以可以加Zn和Mn的氧化物或氢氧化物或碳酸盐来调节pH,所以BC正确;
故答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;BC;
(4)滤液C中含有Zn2+、Mn2+,电解时阴极上锰离子得电子生成二氧化锰,其电极方程为:Mn2++2H2O-2e-═MnO2+4H+;若“酸浸”时所加入的试剂甲为盐酸,则溶液中含有大量的氯离子,则电解时阳极上氯离子失电子生成氯气;
故答案为:Mn2++2H2O-2e-═MnO2+4H+;Cl2;
(5)偏铝酸钠溶液中通入二氧化碳生成碳酸氢钠和氢氧化铝沉淀,其反应的化学方程式为:NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3;
故答案为:NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3;
(6)滤液C电解得到Zn、MnO2,分离过程中用到Zn、MnO2,所以产品Zn、MnO2和H2SO4都可以循环利用;
故答案为:产品Zn、MnO2都可以循环利用.
点评 本题考查了物质的分离提纯操作的综合应用,为高考常考题型,把握流程中混合物分离提纯、除杂及发生的反应为解答的关键,侧重分析、实验、推断能力的综合考查,题目难度中等,注意把握分离流程以及电解原理的应用.

 互动英语系列答案
互动英语系列答案| A. | 第IA族元素铯的两种同位素137Cs比133Cs多4个质子 | |
| B. | 元素周期表有十八个纵列,共十六个族 | |
| C. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 | |
| D. | 第2周期元素从左到右,最高正价从+1递增到+7 |
| A. | CH3CH=CH2+Br2→CH3CHBrCH2Br | |
| B. | CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2+H2O | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| D. | C6H6+HNO3$→_{△}^{浓H_{2}SO_{4}}$C6H5NO2+H2O |
| A. | 已知常温下0.1mol•L-1NaHA溶液的pH=9,则:c(Na+)═c(A2-)+c(HA-)+c(H2A) | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| C. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中先滴加NaCl溶液至不再有沉淀生成,继续滴加Na2S溶液,观察到白色沉淀转化为黑色,则溶解度大小关系为:Ag2S>AgCl |
| A. | NaCl和HNO3 | B. | H2O和NH3 | C. | CaF2和MgCl2 | D. | CCl4和HCl |

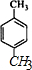
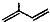 命名为2-甲基-1,3-丁二烯.
命名为2-甲基-1,3-丁二烯.
 ,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;
,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;