题目内容
7.若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池能(填“能”或“不能”),若能,请写出电极反应式,负极Cu-2e-=Cu2+,正极2Fe3++2e-=2Fe2+.(若不能,后两空不填)分析 铜、石墨和硫酸铁溶液,铜能自发的和硫酸铁反应发生氧化还原反应,且铜和石墨的活泼性不同,所以能形成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,由此分析解答.
解答 解:铜、石墨的活泼性不同且都导电,铜和硫酸铁能自发的进行氧化还原反应,所以铜、石墨、硫酸铁溶液能构成原电池,铜易失去电子发生氧化反应,所以铜作负极,石墨作正极,负极上的电极反应式为:Cu-2e-=Cu2+,正极上铁离子得电子发生还原反应,电极反应式为2Fe3++2e-=2Fe2+,
故答案为:能;Cu-2e-=Cu2+,2Fe3++2e-=2Fe2+.
点评 本题考查了原电池的原理,根据原电池构成条件来分析解答即可,注意构成原电池的反应必须是自发进行的且是放热的氧化还原反应,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列反应体系中,不属于可逆反应的是( )
| A. | SO2与水反应 | |
| B. | 氨气与水反应 | |
| C. | 工业合成氨 | |
| D. | 水电解生成H2和O2与H2在O2中燃烧生成H2O |
2.X、Y、Z、R为四种同一周期的非金属元素,它们的最高价氧化物对应的水化物中,酸性最弱的是( )
| A. | H2XO3 | B. | H2YO4 | C. | HZO4 | D. | H3RO4 |
19.向溴水、溴的四氯化碳溶液中分别通入丙烯,下列判断正确的是( )
| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |
17.“N原子2P轨道上有3个未成对电子”,支撑这一结论的理论是( )
| A. | 构造原理 | B. | 泡利原理 | C. | 洪特规则 | D. | 能量最低原理 |
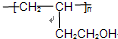 .
. X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白.
X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白. 3CO2+2Fe.(用化学方程式表示)
3CO2+2Fe.(用化学方程式表示)