题目内容
4.白色固体X(仅含有四种元素),在造纸工业中用作木质素脱除剂,纺织工业中只用作人造纤维的稳定剂,电子工业中制造光敏电阻,食品工业中用作抗氧化剂,某研究小组为了探究X的组成和性质,设计并完成了如下实验:
另取25.20g在惰性气体中加热,低于150℃时得到12.60g固体,温度高于150℃时完全分解得到1.95g固体Y和10.65g固体Z,请回答下列问题:
(1)X的化学式为Na2SO3•7H2O,固体Y的电子式
 ,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;
,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;(2)固体Y的水溶液,露置在空气中会有什么现象产生,写出产生该现象的化学方程式:4Na2S+O2+2H2O═4NaOH+2Na2S2;
(3)一定条件下,固体Z与木炭混合加热能发生氧化还原反应,写出其可能的氧化还原反应式Na2SO4+4C$\frac{\underline{\;\;△\;\;}}{\;}$Na2S+4CO↑.
分析 白色固体X(仅含有四种元素),在造纸工业中用作木质素脱除剂,纺织工业中只用作人造纤维的稳定剂,电子工业中制造光敏电阻,食品工业中用作抗氧化剂,X与硫酸反应生成气体甲,甲能被氢氧化钠吸收,所以甲应为酸性氧化物的气体,与氢氧化钠反应后的甲溶液能与氯化钡产生沉淀,且能使溴水褪色,则溶液甲应为Na2SO3,气体甲为SO2,溶液甲蒸发浓缩得固体X,则X为Na2SO3•xH2O,加热先失去结晶水,25.20gX在惰性气体中加热,低于150℃时得到12.60g固体,则有$\frac{126}{126+18x}=\frac{12.6}{25.2}$,所以x=7,根据12.60g固体,温度高于150℃时完全分解得到1.95g固体Y和10.65g固体Z,结合氧化还原反应中电子得失守恒可知,再加热Na2SO3,会发生自身氧化还原反应,生成硫化钠和硫酸钠,方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S,生成的Na2SO4和Na2S的质量之比为$\frac{142×3}{78}=\frac{10.65}{1.95}$,符合题中物质的转化关系,所以Y为Na2S,Z为Na2SO4,据此答题.
解答 解:白色固体X(仅含有四种元素),在造纸工业中用作木质素脱除剂,纺织工业中只用作人造纤维的稳定剂,电子工业中制造光敏电阻,食品工业中用作抗氧化剂,X与硫酸反应生成气体甲,甲能被氢氧化钠吸收,所以甲应为酸性氧化物的气体,与氢氧化钠反应后的甲溶液能与氯化钡产生沉淀,且能使溴水褪色,则溶液甲应为Na2SO3,气体甲为SO2,溶液甲蒸发浓缩得固体X,则X为Na2SO3•xH2O,加热先失去结晶水,25.20gX在惰性气体中加热,低于150℃时得到12.60g固体,则有$\frac{126}{126+18x}=\frac{12.6}{25.2}$,所以x=7,根据12.60g固体,温度高于150℃时完全分解得到1.95g固体Y和10.65g固体Z,结合氧化还原反应中电子得失守恒可知,再加热Na2SO3,会发生自身氧化还原反应,生成硫化钠和硫酸钠,方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S,生成的Na2SO4和Na2S的质量之比为$\frac{142×3}{78}=\frac{10.65}{1.95}$,符合题中物质的转化关系,所以Y为Na2S,Z为Na2SO4,
(1)根据上面的分析可知,X的化学式为Na2SO3•7H2O,Y为Na2S,固体Y的电子式为 ,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S,
,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S,
故答案为:Na2SO3•7H2O; ;4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;
;4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;
(2)Y为Na2S,Y的水溶液,露置在空气中会被氧气氧化生成Na2S2,所以有黄色溶液溶液出现,产生该现象的化学方程式为:4Na2S+O2+2H2O═4NaOH+2Na2S2,
故答案为:溶液呈黄色;4Na2S+O2+2H2O═4NaOH+2Na2S2;
(3)Z为Na2SO4,一定条件下,固体Z与木炭混合加热能发生氧化还原反应,根据电子得失守恒可知,可能的氧化还原反应方程式为Na2SO4+4C$\frac{\underline{\;\;△\;\;}}{\;}$Na2S+4CO↑,
故答案为:Na2SO4+4C$\frac{\underline{\;\;△\;\;}}{\;}$Na2S+4CO↑.
点评 本题考查硫及其化合物的推断以及氧化还原反应,明确发生的氧化还原反应及习题中的信息是解答本题的关键,注意元素的化合价变化及电子守恒的应用,题目难度中等.

 期末集结号系列答案
期末集结号系列答案| A. | 一氯甲烷的结构式CH3Cl | B. | 丙烷分子的球棍模型 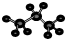 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 苯的分子式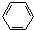 |
| A. | 反应现象相同,反应类型相同 | B. | 反应现象相同,反应类型不同 | ||
| C. | 反应现象不同,反应类型相同 | D. | 反应现象不同,反应类型不同 |

| A. | 乙酸 | B. | 乙醇 | C. | 碳酸钠溶液 | D. | 溴水 |
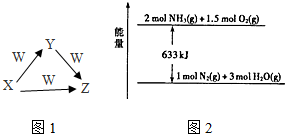 X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白.
X、Y、Z、W为中学化学常见的物质,它们之间的转化关系如图所示.请填写下列空白. 3CO2+2Fe.(用化学方程式表示)
3CO2+2Fe.(用化学方程式表示)
 分析图,回答以下问题:
分析图,回答以下问题: