题目内容
1.碘化钠是实验室中常见的分析试剂,常用于医疗和照相业.工业上通常用水合肼(N2H4•H2O,100℃以上分解)还原法制取碘化钠,工艺流程如下:
(1)合成过程的反应产物中含有IO3-,写出合成过程的离子方程式3I2+6OH-=5I-+IO3-+3H2O.
(2)还原过程必须保持反应温度在60~70℃,这个温度既能保证反应的快速进行,又能避免N2H4•H2O高温分解.工业上也可以用Na2S或Fe屑还原制备碘化钠,但水合肼还原法制得的产品纯度更高,原因是N2H4•H2O的氧化产物为N2和H2O.
(3)请补充完整检验还原液中是否含有IO3-的实验方案:取适量还原液,加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-.
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液.
(4)测定产品中NaI含量的实验步骤如下:
A.称取4.000g样品、溶解,在250m L容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.用0.1000mol•L-1AgNO3溶液滴定至终点,记录消耗AgNO3溶液的体积;
d.重复b,c操作2~3次,记录相关实验数据.
①滴定过程中,AgNO3溶液应放在酸式滴定管中;步骤d的目的是减少实验误差.
②若用上述方法测定产品中的NaI含量偏低(忽略测定过程中的误差),其可能的原因是部分NaI被空气中O2氧化.
分析 合成过程的反应产物中含有IO3-,发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,即发生反应:3N2H4•H2O+2NaIO3=2NaI+3N2↑+9H2O,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI.
(1)根据发生的反应改写为离子方程式;
(2)由于N2H4•H2O,100℃以上分解,应控制温度,防止水合肼分解;N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质;
(3)加入淀粉溶液,加盐酸酸化,若含有IO3-,会与I-反应生成I2,淀粉遇碘变蓝色;
(4)①稀溶液溶液呈酸性,应放在酸式滴定管中;重复操作,减少实验误差;
②部分NaI被空气中O2氧化.
解答 解:合成过程的反应产物中含有IO3-,发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,即发生反应:3N2H4•H2O+2NaIO3=2NaI+3N2↑+9H2O,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI.
(1)发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,离子方程式为:3I2+6OH-=5I-+IO3-+3H2O,
故答案为:3I2+6OH-=5I-+IO3-+3H2O;
(2)由于N2H4•H2O,100℃以上分解,反应温度在60~70℃,这个温度既能保证反应的快速进行,又能避免N2H4•H2O高温分解;
N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质,水合肼还原法制得的产品纯度更高,
故答案为:避免N2H4•H2O高温分解;N2H4•H2O的氧化产物为N2和H2O;
(3)检验还原液中是否含有IO3-的实验方案:取适量还原液,加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-,
故答案为:加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-;
(4)①稀溶液溶液呈酸性,应放在酸式滴定管中;重复操作,减少实验误差,
故答案为:酸式滴定管;减少实验误差;
②部分NaI被空气中O2氧化,导致滴定消耗硝酸银溶液偏小,测定产品中的NaI含量偏低,
故答案为:部分NaI被空气中O2氧化.
点评 本题考查物质制备实验,明确制备流程中发生的反应是解题关键,注意对题目信息的提取应用,题目难度中等.


| A. | 6 | B. | 8 | C. | 12 | D. | 14 |

| A. | 乙酸 | B. | 乙醇 | C. | 碳酸钠溶液 | D. | 溴水 |
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
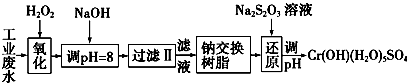
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
 如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )
如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )| A. | X:SO2,Y:饱和NaHCO3溶液 | B. | X:Cl2,Y:饱和Na2SO3溶液 | ||
| C. | X:HCl,Y:饱和NaHSO3溶液 | D. | X:CO2,Y:饱和Na2CO3溶液 |

 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: