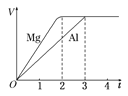
题目内容
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
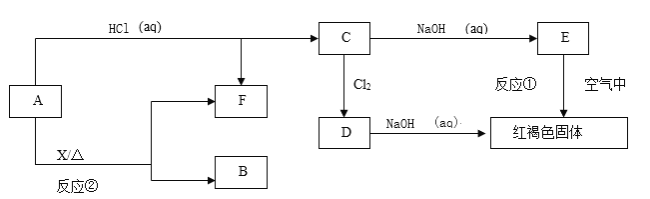
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:__________________、__________________ 。
(2)写出下列反应的化学方程式:
反应①____________________________________________________________ 。
反应②______________________________________________________________________。
(3)将B溶于盐酸完全反应,试写出反应的离子方程式:___________________________,为证明反应后溶液中浓度较低的金属离子的存在,操作为____________________
【答案】Fe3O4 FeCl3 4Fe(OH)2+O2+2H2O═4Fe(OH)3 3Fe+4H2O(g)![]() Fe3O4+4H2 Fe3O4+8H+=2Fe3++Fe2++4H2O 取少量溶液于试管中,加适量蒸馏水稀释,再加入K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明溶液中含有Fe2+
Fe3O4+4H2 Fe3O4+8H+=2Fe3++Fe2++4H2O 取少量溶液于试管中,加适量蒸馏水稀释,再加入K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明溶液中含有Fe2+
【解析】
A是金属单质,与盐酸反应生成C为金属氯化物,C与氢氧化钠反应生成E,E被空气中氧气氧化生成红褐色固体,该红褐色固体为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,故A为Fe。C与氯气反应生成D为FeCl3,FeCl3能与NaOH溶液反应生成Fe(OH)3,根据转化关系可知,F为氢气,Fe与X再加热的条件下也可以生成氢气,应是Fe与水蒸气的反应生成四氧化三铁和氢气,则X为水,B为四氧化三铁,据此解答。
由上述分析可知:A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为H2。
(1)由上述分析可知,B为Fe3O4;D为FeCl3;
(2)反应①为Fe(OH)2在空气中转化为Fe(OH)3,其化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;反应②为Fe与水蒸气的反应:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)Fe3O4与盐酸的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O;若要证明混合溶液中的Fe2+,可取少量溶液于试管中,加适量蒸馏水稀释,再加入K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明溶液中含有Fe2+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
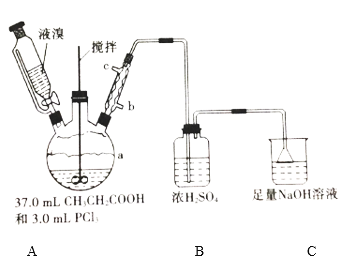
小学生10分钟应用题系列答案【题目】2—溴丙酸(CH3CHBrCOOH)是有机合成的重要中间体。实验室制备2—溴丙酸的反应(PCl3易潮解)、装置示意图(加热和夹持装置略去)和有关数据如下:CH3CH2COOH+Br2 → CH3CHBrCOOH+HBr
物质 | 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
Br2 | 160 | 3.1 | 58.8 | 微溶于水,易溶于有机 |
CH3CH2COOH | 74 | 0.99 | 141.1 | 易溶于水和有机溶剂 |
CH3CHBrCOOH | 153 | 1.7 | 203(分解) | 能溶于水和有机溶剂 |
请回答:
(1)检验a装置气密性的方法:盖紧滴液漏斗玻璃塞,_____________________,观察到导管口有气泡冒出,撤走热源后,导管中进入一段水柱,则证明气密性良好。
(2)按上图所示添加药品,先水浴加热a,再向a中滴加足量液溴,充分反应后,停止加热。
①a的容积最适合的是__________(填选项字母)
A.50 mL B.100 mL C.250 mL D.500 mL
②冷凝管的出水口为__________(填“b”或“c”)。
③C装置的作用为________________________________________。
(3)冷却至室温后,将a中液体减压蒸馏、纯化,收集得27.0 mL CH3CHBrCOOH。
①采用减压蒸馏的原因为_______________________________________。
②本实验的产率为_________。
(4)欲用上述装置验证a中发生取代反应,需更换B、C中的试剂。则C中应加入的试剂为____________;装置B的作用为____________。
【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
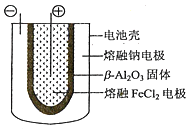
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。