题目内容
(15分)A、B、C、D、E、W均为短周期元素,原子序数依次增大。回答下列问题:
(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式: 。
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)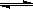 CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。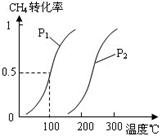
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(3)由A、C、D元素原子组成的化合物N2H4和H2O2 有广泛的用途。
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。电池放电时,负极的电极反应式为 。
②已知:16 g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75 KJ的热量。 H2O(1)=H2O(g) △H="+44" kJ·mol-1
2H2O2(1)=2H2O(1)+O2(g) △H=-196.4 kJ·mol-1
写出N2H4(肼)与氧气反应的热化学方程式为 。
(1) 略(2分)
(2)① 0.0030mol·L-1·min-1(2分) ② <(2分); 2.25×10-4 (2分) ③减小(2分)
(3)①N2H4+4OH—→N2↑+4H2O+4e—(2分)
②N2H4(1)+O2(g)=N2(g)+2H2O(1) △H=-621.1kJ·mol—1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ·mol—1(3分)
解析

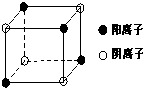 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.