题目内容
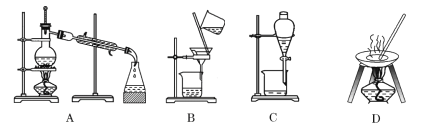
【题目】(I)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请根据该装置回答下列问题:
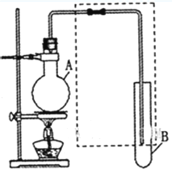
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A中加入的试剂在混合时的操作方法是___________,反应的化学方程式为___________,试管B中应加入___________。虚线框中的导管除用于导气外,还兼有___________作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
(3)若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________,试管B中应加入___________。
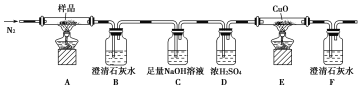
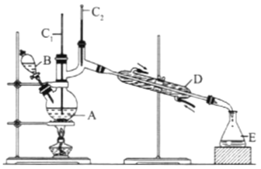
(II)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛,发生:CH3CH2CH2CH2OH→![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。
反应物和产物的相关数据列表:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由:__________。
(2)加入沸石的作用是__________;若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,B仪器的名称是__________,D仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是(填字母)__________。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在__________层(填“上”,或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________。
(7)本实验中,正丁醛的产率为__________%。.
【答案】先加入一定量的乙醇,然后边摇动烧瓶边慢慢加入一定量的浓硫酸,冷却后再加乙酸 CH3COOH+C2H5OH![]() CH3COOCH2CH3+H2O 饱和碳酸钠溶液 冷凝 生石灰 CH3CH2CH2OH 浓硫酸 CH3COOH(其他答案合理) 碳酸钠和醋酸 苯酚钠溶液 不能,易迸溅 防止暴沸 冷却后补加 分液漏斗 直形冷凝管 C 下 既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化 51.3
CH3COOCH2CH3+H2O 饱和碳酸钠溶液 冷凝 生石灰 CH3CH2CH2OH 浓硫酸 CH3COOH(其他答案合理) 碳酸钠和醋酸 苯酚钠溶液 不能,易迸溅 防止暴沸 冷却后补加 分液漏斗 直形冷凝管 C 下 既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化 51.3
【解析】
(I)(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水;
(2)乙酸和1-丙醇混合形成恒沸液,分离乙酸和1-丙醇时,应先将乙酸转化为离子化合物,形成沸点差异,再蒸馏;
(3)应用强酸制弱酸的原理设计实验;
(II)(1)Na2Cr2O7溶液和浓硫酸混合时相当于浓硫酸的稀释;
(2)沸石能防止溶液暴沸,若加热后发现未加沸石,应该冷却后补加,不能直接加入沸石;
(3)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管;
(4)含有活塞的仪器使用前必须检漏,分液漏斗中含有活塞,所以使用前必须检漏;
(5)分液时,密度小的液体位于上方,密度大于的液体位于下方;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)由题给数据和公式计算可得。
(I)(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸;酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;生成的乙酸乙酯蒸汽中含有乙醇和乙酸,要用饱和碳酸钠溶液分离混合物;长导管起到导气和冷凝乙酸丙酯蒸汽的作用,故答案为:先加入乙醇,然后边摇动烧瓶边慢慢加入浓硫酸,冷却后再加乙酸;CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;生成的乙酸乙酯蒸汽中含有乙醇和乙酸,要用饱和碳酸钠溶液分离混合物;长导管起到导气和冷凝乙酸丙酯蒸汽的作用,故答案为:先加入乙醇,然后边摇动烧瓶边慢慢加入浓硫酸,冷却后再加乙酸;CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;饱和碳酸钠溶液;冷凝;
CH3COOCH2CH3+H2O;饱和碳酸钠溶液;冷凝;
(2)乙酸和1-丙醇混合形成恒沸液,分离乙酸和1-丙醇时,应先在乙酸和1-丙醇的混合液中加入CaO,把乙酸转化为盐溶液,加热蒸馏,试管B中收集到的馏分为丙醇,烧瓶中剩余的为乙酸钙的水溶液,再加浓硫酸得到乙酸,通过蒸馏分离得到乙酸,故答案为:CaO;CH3CH2CH2OH;浓硫酸;CH3COOH;
(3)若要证明酸性:醋酸>碳酸>苯酚,应在烧瓶A中加入苯酚钠和醋酸,有气泡产生,说明反应生成二氧化碳气体,证明酸性:醋酸>碳酸;将生成的二氧化碳通入盛有苯酚钠溶液试管B中,溶液变浑浊,证明酸性:碳酸>苯酚,故答案为:碳酸钠和醋酸;苯酚钠溶液;
(II)(1)Na2Cr2O7溶液和浓硫酸混合时相当于浓硫酸的稀释,应该将浓硫酸倒入Na2Cr2O7溶液,不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅,故答案为:不能,易迸溅;
(2)沸石能防止溶液暴沸,若加热后发现未加沸石,应该冷却后补加,不能直接加入沸石,
故答案为:防止暴沸;冷却后补加;
(3)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管,故答案为:分液漏斗;直形冷凝管;
(4)含有活塞的仪器使用前必须检漏,分液漏斗中含有活塞,所以使用前必须检漏,故答案为:C;
(5)分液时,密度小的液体位于上方,密度大于的液体位于下方,正丁醛密度小于水,所以水位于下方,故答案为:下;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O可得74:72=4xg:2g,解得x=![]() ×100%=51.3%,故答案为:51.3。
×100%=51.3%,故答案为:51.3。

【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
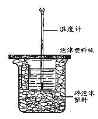
(1)图中未画出的实验器材是______________。
(2)烧杯间填满碎纸条的作用是 ___________________________。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
①试计算上述实验测出的中和热ΔH1=______________。
②如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”)
③如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将____(填“偏大”、“偏小”、“不变”) , 其理由是___