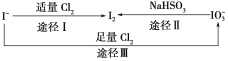
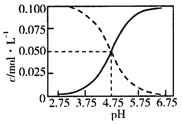
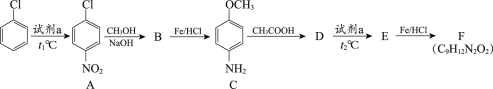
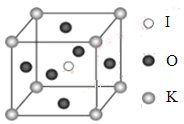
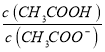题目内容
【题目】I.自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。
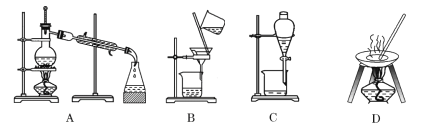
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙__________;
(2)氯化钠溶液中分离出氯化钠___________;
(3)分离39%的乙醇溶液___________;
(4)分离溴的氯化钠溶液____________;
Ⅱ.利用“化学计量在实验中的应用”的相关知识进行填空
已知某饱和氯化钠溶液体积为VmL,溶液密度为d g/cm3,质量分数为w,物质的量浓度为c mol/L,溶液中含NaCl的质量为m g。
(1)用m、V表示溶液的物质的量浓度是_________
(2)用w、d表示溶液的物质的量浓度是_________
(3)用c、d表示溶液的质量分数是__________
【答案】B D A C ![]() mol·L-1
mol·L-1 ![]() mol·L-1
mol·L-1 ![]()
【解析】
I. 根据混合物的性质选择相应的装置进行分离;
Ⅱ. 根据公式![]() 、
、![]() 、
、![]() 进行计算。
进行计算。
I. (1)碳酸钙不溶于水,可用过滤的方法从碳酸钙悬浊液中分离出碳酸钙,故答案为:B;
(2)氯化钠易溶于水,可用蒸发的方法从氯化钠溶液中分离出氯化钠,故答案为:D;
(3)乙醇和水是互溶的两种液体,可用蒸馏的方法分离乙醇和水,故答案为:A;
(4)溴易溶于四氯化碳而难溶于水,且四氯化碳与水不互溶,则可以用四氯化碳萃取氯化钠溶液中的溴单质,再分液,故答案为:C;
Ⅱ. (1)NaCl的物质的量为![]() ,则NaCl溶液的物质的量浓度是
,则NaCl溶液的物质的量浓度是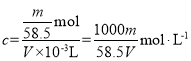 ,故答案为:
,故答案为:![]() mol·L-1;
mol·L-1;
(2)根据公式![]() 可知,该溶液的物质的量浓度是
可知,该溶液的物质的量浓度是![]() ,故答案为:
,故答案为:![]() mol·L-1;
mol·L-1;
(3)由![]() 可知,
可知,![]() ,则该溶液的质量分数是
,则该溶液的质量分数是![]() ,故答案为:
,故答案为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
【题目】(I)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请根据该装置回答下列问题:
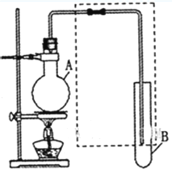
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A中加入的试剂在混合时的操作方法是___________,反应的化学方程式为___________,试管B中应加入___________。虚线框中的导管除用于导气外,还兼有___________作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
(3)若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________,试管B中应加入___________。
(II)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛,发生:CH3CH2CH2CH2OH→![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。
反应物和产物的相关数据列表:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
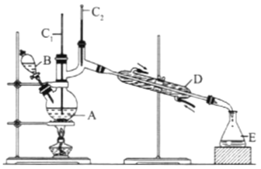
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由:__________。
(2)加入沸石的作用是__________;若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,B仪器的名称是__________,D仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是(填字母)__________。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在__________层(填“上”,或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________。
(7)本实验中,正丁醛的产率为__________%。.