题目内容
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
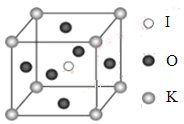
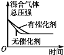
(1)如图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH________0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为______________。
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
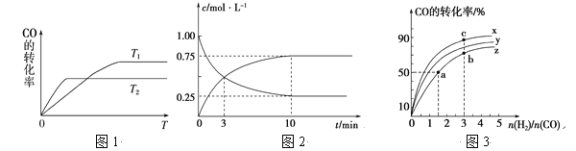
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________。
【答案】< > 12 b 270 K1=K2< K3
【解析】
(1)①根据图像信息结合勒夏特列原理判断;
②正反应为放热反应,升高温度,平衡逆向进行,则化学平衡常数减小;利用三段式计算平衡时各量的浓度,再计算K。
③a.容器容积不变,升高温度,平衡逆向移动,CO的转化率降低,a错误;
b.将CH3OH(g)从体系中分离,平衡正向移动,CO的转化率增大,b正确;
c.使用合适的催化剂不会引起化学平衡的移动,CO的转化率不变,c错误;
d.容器容积不变,充入He,使体系总压强增大,各物质的浓度不变,化学平衡不移动,CO的转化率不变,d错误;
(2)反应为放热反应,温度越高CO的转化率越小;化学平衡常数只与温度有关,反应为放热反应,升高温度,平衡常数减小。
(1)①根据图中的信息可知:T2>T1,温度越高CO转化率越小,则反应CO(g)+2H2(g)![]() CH3OH(g)中,降低温度,平衡向右进行,一氧化碳的转化率增大,根据勒夏特列原理,正反应是放热反应,△H<0;
CH3OH(g)中,降低温度,平衡向右进行,一氧化碳的转化率增大,根据勒夏特列原理,正反应是放热反应,△H<0;
②正反应为放热反应,升高温度,平衡逆向进行,则化学平衡常数减小,T2>T1,则K1>K2;在T1温度下,根据图2所示,10min时达到平衡状态,已知CO的浓度为1mol/L,则图像为CO与CH3OH的浓度变化,平衡时,c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
初始:1 2 0
反应:0.75 1.5 0.75
平衡:0.25 0.5 0.75
K=0.75/(0.25×0.52)=12;
③a.容器容积不变,升高温度,平衡逆向移动,CO的转化率降低,a错误;
b.将CH3OH(g)从体系中分离,平衡正向移动,CO的转化率增大,b正确;
c.使用合适的催化剂不会引起化学平衡的移动,CO的转化率不变,c错误;
d.容器容积不变,充入He,使体系总压强增大,各物质的浓度不变,化学平衡不移动,CO的转化率不变,d错误;
答案为b;
(2)反应为放热反应,温度越高CO的转化率越小,曲线Z为270℃;化学平衡常数只与温度有关,则K1=K2,反应为放热反应,升高温度,平衡常数减小,则曲线x为230 ℃,K1=K2< K3。

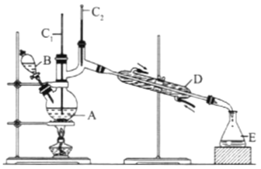
【题目】(I)如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请根据该装置回答下列问题:
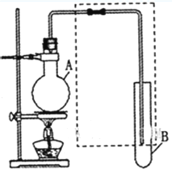
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A中加入的试剂在混合时的操作方法是___________,反应的化学方程式为___________,试管B中应加入___________。虚线框中的导管除用于导气外,还兼有___________作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A中除加入1-丙醇与乙酸外,还应先加入适量的试剂___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
(3)若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________,试管B中应加入___________。
(II)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛,发生:CH3CH2CH2CH2OH→![]() CH3CH2CH2CHO。
CH3CH2CH2CHO。
反应物和产物的相关数据列表:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 11.72 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由:__________。
(2)加入沸石的作用是__________;若加热后发现未加沸石,应采取的正确方法是__________。
(3)上述装置图中,B仪器的名称是__________,D仪器的名称是__________。
(4)分液漏斗使用前必须进行的操作是(填字母)__________。
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,水在__________层(填“上”,或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________。
(7)本实验中,正丁醛的产率为__________%。.
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2的浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. AB. BC. CD. D