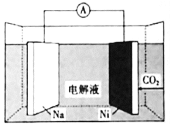
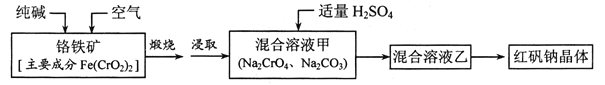
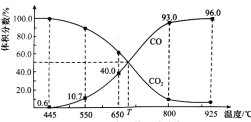
题目内容
【题目】化合物X(仅含三种短周期元素)是一种储氢材料,X中某种元素的单质常用来制造信号弹和烟火,某研究小组为了探究X的组成和性质,设计并完成了如下实验。(金属互化物——全部由金属元素组成的化合物)
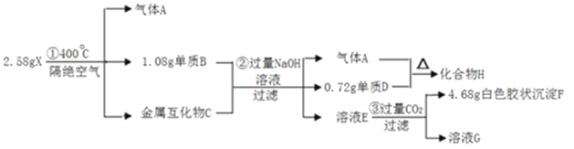
(1)写出H的电子式:________。
(2)X在400℃下分解的化学方程式:________。
(3)下列说法中正确的有:________。
A.化合物H可以与水反应生成氢气 B.单质D可以在干冰中燃烧 C.往溶液E中逐滴加入稀盐酸,将立刻产生白色沉淀 D.溶液G的成分可用于泡沫灭火器
(4)金属化合物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为:________。
【答案】![]()
![]() ABD 2:1
ABD 2:1
【解析】
化合物(仅含三种短期元素)是一种络合氢化物的储氢材料,在400℃下分解,放出氢气,则A为H2,X中某种元素的单质常用来制造信号弹和烟火,应含有Mg元素,溶液E通入二氧化碳生成白色胶状沉淀,则F应为Al(OH)3,可知X含有Mg、Al、H这3种元素,由转化关系可知D为Mg,H为MgH2,B为Al,由题中数据可知n(Mg)=![]() =0.03mol,n(Al)=
=0.03mol,n(Al)=![]() =0.04mol,n(Al(OH)3)=
=0.04mol,n(Al(OH)3)=![]() =0.06mol,可知X中含有Al的物质的量为0.06mol,C为Mg3Al2,则n(H)=
=0.06mol,可知X中含有Al的物质的量为0.06mol,C为Mg3Al2,则n(H)=![]() =0.24mol,则X的化学式为Mg(AlH4)2,以此解答该题。
=0.24mol,则X的化学式为Mg(AlH4)2,以此解答该题。
(1)H为MgH2,为离子化合物,电子式为[H:]Mg2+[H:],故答案为:[H:]Mg2+[H:];
(2)X在400℃下分解的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)A.化合物H为MgH2,可以与水发生氧化还原反应生成氢气,故A正确;
B.质D为Mg,可以在干冰中燃烧,故B正确;
C.溶液E中含有过量的氢氧化钠,逐滴加入稀盐酸,不立刻产生白色沉淀,故C错误;
D.溶液G含有碳酸氢钠,可用于泡沫灭火器,故D正确;
故答案为:ABD;
(4)C为Mg3Al2,Mg、Al都可与盐酸反应,而只有Al与氢氧化钠溶液反应,则1mol C与盐酸反应可生成6mol氢气,与氢氧化钠溶液反应,可生成3mol氢气,则物质的量之比为2:1,故答案为:2:1。

 名校课堂系列答案
名校课堂系列答案【题目】对于如下反应,其反应过程的能量变化示意图如图:
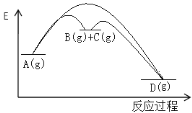
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g) | K1 | △H1 |
反应② | B(g)+C(g) | K2 | △H2 |
反应③ | A(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2
B. ΔH3=ΔH1 +ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变