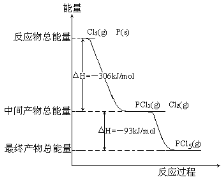
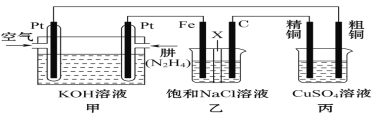
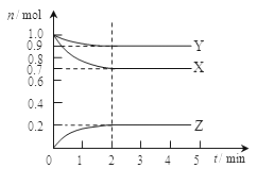
题目内容
【题目】在一个体积为1L的密闭容器中发生某化学反应:2A(g)![]() B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。试回答下列问题:
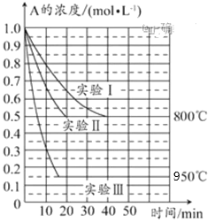
(1)在实验Ⅰ中,反应在20~40min内A的平均反应速率为__mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是___。
(2)该反应的ΔH___0,其判断理由是___。
(3)实验Ⅰ第40min末,若降低反应温度,达到新的平衡后,A的浓度不可能为___(填序号)。
A.0.35mol·L-1 B.0.4mol·L-1 C.0.7mol·L-1 D.0.8mol·L-1
(4)若反应在800℃进行,在该1L的密闭容器中加入1molA、0.2molHe,达到平衡时A的转化率应___。
A.等于86% B.等于50% C.小于50% D.介于50%~86%之间
【答案】0.0075 实验Ⅱ使用了催化剂 > 根据实验Ⅲ和实验Ⅰ的比较,可推知升高温度,平衡正向移动,该反应为吸热反应 AB D
【解析】
(1)实验Ⅰ中,反应在20min至40min内A的浓度变化为0.55mol/L-0.4mol/L=0.15mol/L,再根据υ=c÷t计算;实验Ⅱ和实验I相比,A的起始浓度相同,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快;
(2)实验Ⅲ和实验Ⅰ的比较,升高温度,平衡时A的浓度减小,平衡向正反应移动;
(3)降低温度,平衡逆向移动,A的浓度增大;
(4)恒容充惰性气体,对原平衡不产生影响。
(1)实验Ⅰ中,反应在20min至40min内A的浓度变化为0.55mol/L0.4mol/L=0.15mol/L,所以υ(A)=0.15mol/L÷20min=0.0075molL1min1;
实验Ⅱ和实验I相比,A的起始浓度相同,平衡状态完全相同,平衡时A的浓度相同,但实验Ⅱ的反应速率快,改变压强虽然平衡不移动,但物质的浓度发生变化,故实验Ⅱ应该使用了催化剂。
故答案为:0.0075;实验Ⅱ使用了催化剂;
(2)实验Ⅲ和实验Ⅰ的比较,升高温度,平衡时A的浓度减小,平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故△H>0,
故答案为:>;根据实验Ⅲ和实验Ⅰ的比较,可推知升高温度,平衡正向移动,该反应为吸热反应;
(3)降低温度,平衡逆向移动,A的浓度增大,故A的浓度大于0.4molL1,
故答案为:AB;
(4)恒容充惰性气体,对原平衡不产生影响,故平衡时A的浓度为0.4molL1,故A的转化率为(1mol/L0.4mol/L)÷1mol/L×100%=60%,
故答案为:D。