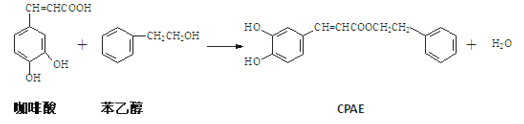
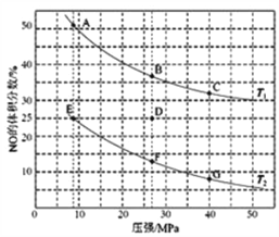
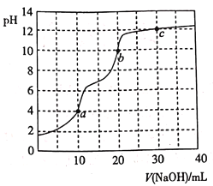
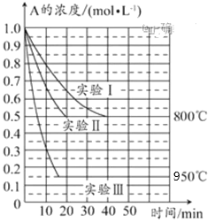
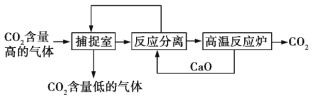
题目内容
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因CO![]() 水解而使其水溶液呈碱性,写出CO
水解而使其水溶液呈碱性,写出CO![]() 第一步水解的离子方程式:_________________________________________________________________。
第一步水解的离子方程式:_________________________________________________________________。
已知25 ℃时,CO![]() 第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO
第一步水解的平衡常数Kh=2×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=20∶1时,溶液的pH=________。
)=20∶1时,溶液的pH=________。
②泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式: _____________________________________________________________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1 CH3COONa溶液,则两份溶液中c(NO![]() )、c(NO
)、c(NO![]() ) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
) 和c(CH3COO-)由大到小的顺序为____________________,(已知HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。可使溶液A和溶液B的pH相等的方法是________。
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
【答案】CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH- 9 3HCO
+OH- 9 3HCO![]() +Al3+===Al(OH)3↓+3CO2↑ c(NO
+Al3+===Al(OH)3↓+3CO2↑ c(NO![]() )>c(NO
)>c(NO![]() )>c(CH3COO-) AD
)>c(CH3COO-) AD
【解析】
(1)①CO![]() 第一步水解生成碳酸氢根离子、氢氧根离子;
第一步水解生成碳酸氢根离子、氢氧根离子;
CO![]() 第一步水解的平衡常数Kh=
第一步水解的平衡常数Kh=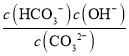 ;
;
②NaHCO3和Al2(SO4)3溶液混合,发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(2) HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1,酸性HNO2 >CH3COOH,所以CH3COO-水解程度大于NO![]() 。等浓度的CH3COONa溶液的pH大于NaNO2,要使pH相等,可以降低CH3COONa溶液的pH或升高NaNO2溶液的pH;
。等浓度的CH3COONa溶液的pH大于NaNO2,要使pH相等,可以降低CH3COONa溶液的pH或升高NaNO2溶液的pH;
(1)①CO![]() 第一步水解生成碳酸氢根离子、氢氧根离子,水解的离子方程式为CO
第一步水解生成碳酸氢根离子、氢氧根离子,水解的离子方程式为CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-;
+OH-;
CO![]() 第一步水解的平衡常数Kh=
第一步水解的平衡常数Kh=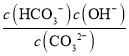 =2×10-4 mol·L-1,当溶液中c(HCO
=2×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=20∶1时,
)=20∶1时,![]() 2×10-4 mol·L-
2×10-4 mol·L-![]() 10-5 mol·L-1,溶液的pH=9;
10-5 mol·L-1,溶液的pH=9;
②NaHCO3溶液和Al2(SO4)3溶液混合,发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式是3HCO![]() +Al3+===Al(OH)3↓+3CO2↑;
+Al3+===Al(OH)3↓+3CO2↑;
(2) 根据方程式2NO2+2NaOH===NaNO3+NaNO2+H2O,含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应生成0.1mol NaNO2、0.1mol NaNO3, 溶液体积为1L,则NaNO2、NaNO3的浓度均为0.1mol/L;HNO3是强酸,NaNO3不水解, HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1,酸性HNO2 >CH3COOH,所以CH3COO-水解程度大于NO![]() ,所以两份溶液中c(NO
,所以两份溶液中c(NO![]() )、c(NO
)、c(NO![]() ) 和c(CH3COO-)由大到小的顺序为c(NO
) 和c(CH3COO-)由大到小的顺序为c(NO![]() )>c(NO
)>c(NO![]() )>c(CH3COO-);
)>c(CH3COO-);
A.向溶液A中加适量NaOH,A的pH升高,能使两溶液pH相等,故选A;
B.向溶液A中加适量水,A的pH降低,不能使两溶液pH相等,故不选B;
C.向溶液B中加适量NaOH,B的pH升高,不能使两溶液pH相等,故不选C;
D.向溶液B中加适量水,B的pH降低,能使两溶液pH相等,故选D;
选AD。

【题目】钛是一种活泼金属。从高钛渣(主要为TiO2)提炼海绵钛流程如下:
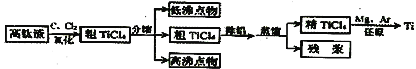
氯化后的粗TiCl4中含有FeCl3、SiCl4、AlCl3等杂质,相关物质的沸点如下表:
化合物 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
沸点/℃ | 136 | 310 | 56.5 | 180 |
下列说法不正确的是( )
A.“氯化”反应的尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是H2O、FeCl2溶液、NaOH溶液
B.“分馏”得到的低沸点物为SiCl4,高沸点物为FeCl3
C.己知“除铝”的方法是用水湿润的活性炭加入到粗TiCl4,目的是将AlCl3转化为Al(OH)3而除去
D.“还原”过程中还原剂可以选择金属钠,气氛可以选择N2