题目内容
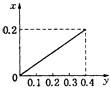
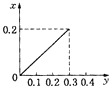
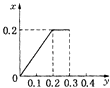
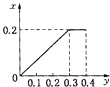
【题目】常温下,向20m1某稀Ba(OH)2溶液中滴入浓度为0.1mol/L的醋酸。溶液中由水电离出的氢氧根离子浓度随滴入醋酸的体积变化如图,下列分析正确的是

A. 稀Ba(OH)2溶液的浓度为0.1molL-1
B. C点溶液的PH=a
C. D点溶液中C(OH-)<C(H+)+C(CH2COOH)
D. E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+)
【答案】D
【解析】从图中看出,C(OH-)(水)=10-13 molL-1,则溶液中的C(OH-)=0.1 molL-1,稀Ba(OH)2溶液的浓度为0.05molL-1,A错误;C点溶液的溶质为醋酸钡和氢氧化钡混合物,水电离产生的C(OH-)为![]() ,同时氢氧化钡电离产生OH-,所以溶液的PH>14-a,B错误;D点溶液醋酸钡溶液,促进了水的电离,溶液水解显碱性,因此根据电荷守恒:2C(Ba2+)+ C(H+)= C(CH2COO-)+ C(OH-),物料守恒:C(CH2COO-)+ C(CH2COOH)=2 C(Ba2+),消去C(Ba2+),得到C(OH-)=C(H+)+C(CH2COOH),C错误;E点溶液为醋酸和醋酸钡的混合液,根据图像可知,该溶液显碱性,醋酸钡的水解过程大于醋酸电离过程,溶液显碱性,因此E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+),D正确;正确选项D。
,同时氢氧化钡电离产生OH-,所以溶液的PH>14-a,B错误;D点溶液醋酸钡溶液,促进了水的电离,溶液水解显碱性,因此根据电荷守恒:2C(Ba2+)+ C(H+)= C(CH2COO-)+ C(OH-),物料守恒:C(CH2COO-)+ C(CH2COOH)=2 C(Ba2+),消去C(Ba2+),得到C(OH-)=C(H+)+C(CH2COOH),C错误;E点溶液为醋酸和醋酸钡的混合液,根据图像可知,该溶液显碱性,醋酸钡的水解过程大于醋酸电离过程,溶液显碱性,因此E点溶液中存在C(CH2COO-)>C(Ba2+)>C(OH-)>C(H+),D正确;正确选项D。

练习册系列答案
相关题目