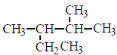题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:
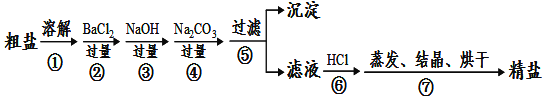
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
【答案】加快粗盐溶解 Na2SO4 NaOH、Na2CO3 CaCO3、BaCO3 会引入K+ 在提纯过程中生成了氯化钠
【解析】
由题给流程图可知,第①步为粗盐溶解操作;第②步操作加入过量BaCl2溶液的目的是除去粗盐中的Na2SO4,但同时引入了BaCl2杂质;第③步操作加入过量NaOH溶液的目的是除去粗盐中MgCl2,但同时引入了NaOH杂质;第④步操作加入过量的Na2CO3溶液的目的是除去粗盐中的氯化钙和过量的氯化钡,但同时引入了Na2CO3杂质;第⑤步过滤操作,得到含有氢氧化钠和碳酸钠杂质的氯化钠溶液;第⑥步操作加入适量盐酸的目的是除去滤液中过量的氢氧化钠和碳酸钠杂质;第⑦步操作为蒸发、结晶、烘干得到精盐。
(1)在第①步粗盐溶解操作中用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故答案为:加快粗盐溶解;
(2)第②步操作加入过量BaCl2溶液的目的是除去粗盐中的Na2SO4;第⑥步操作的目的是除去滤液中过量的氢氧化钠和碳酸钠杂质,故答案为:Na2SO4;NaOH、Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、第②步操作生成的BaSO4、第③步操作生成的Mg(OH)2、第④步操作生成的CaCO3和BaCO3,故答案为:CaCO3、BaCO3;
(4)在第③步操作中,选择的除杂的试剂不能用KOH溶液代替NaOH溶液,若用KOH溶液代替除去粗盐中MgCl2的同时,还会引入难以除去的K+,使得氯化钠中混有氯化钾,故答案为:会引入K+;
(6)第⑥步操作加入适量盐酸时,盐酸与氢氧化钠和碳酸钠反应生成氯化钠,使得精盐的质量大于粗盐中NaCl的质量,故答案为:在提纯过程中生成了氯化钠。

【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
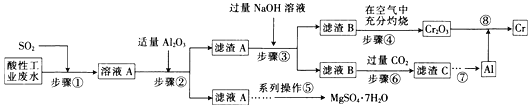
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
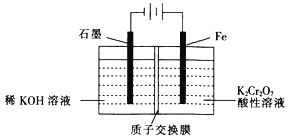
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。