题目内容
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
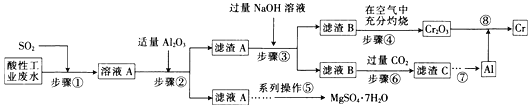
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
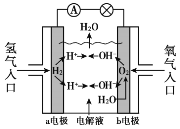
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
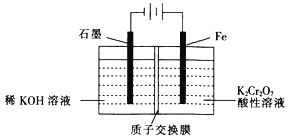
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。
【答案】Cr2O72—+3SO2+2H+=2 Cr3++3SO42—+H2O 调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离 7.8≤pH<9.2 AlO2—+CO2+2 H2O=Al(OH)3↓+HCO3— Fe2+与![]() 发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区 134.4
发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区 134.4
【解析】
(1)步骤①中,SO2有还原性,Cr2O72—在酸性条件下具有强氧化性,二者发生氧化还原反应。
(2)根据题中表格数据,步骤②中加入适量Al2O3的目的是:调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离。
(3)步骤③中的滤渣A为:Al(OH)3和Cr(OH)3,加入NaOH溶液使氢氧化铝溶解。
(4)步骤⑥向滤液B中通入过量CO2,滤液B为偏铝酸钠溶液,偏铝酸钠溶液和过量CO2反应生成Al(OH)3和碳酸氢钠。
(5)①右侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中Cr2O72-氧化,发应生成Cr3+和Fe3+。
②阴极氢离子放电生成氢气,2H++2e-=H2↑,阳极反应为:Fe-2e-= Fe2+。
(1)步骤①中,SO2有还原性,Cr2O72—在酸性条件下具有强氧化性,故发生主要反应的离子方程式为:Cr2O72—+3SO2+2H+=2 Cr3++3SO42—+H2O,故答案为:Cr2O72—+3SO2+2H+=2 Cr3++3SO42—+H2O。
(2)根据题中表格数据,步骤②中加入适量Al2O3的目的是:调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离,故答案为:调节溶液的pH,使Cr3+、Al3+形成沉淀而与Mg2+分离。
(3)步骤③中的滤渣A为:Al(OH)3和Cr(OH)3,加入NaOH溶液使氢氧化铝溶解,故调节溶液的pH范围为:7.8≤pH<9.2,故答案为:7.8≤pH<9.2。
(4)步骤⑥向滤液B中通入过量CO2,滤液B为偏铝酸钠溶液,偏铝酸钠溶液和过量CO2反应生成Al(OH)3和碳酸氢钠,反应的离子方程式为:AlO2—+CO2+2H2O=Al(OH)3↓+HCO3—,故答案为:AlO2—+CO2+2 H2O=Al(OH)3↓+HCO3—。
(5)①右侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中Cr2O72-氧化,发应生成Cr3+和Fe3+,反应的离子方程式:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故在电解过程中阳极区pH增大的原因是:Fe2+与![]() 发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区,故答案为:Fe2+与
发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区,故答案为:Fe2+与![]() 发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区。
发生反应消耗H+,同时H+通过质子交换膜迁移到阴极区。
②阴极氢离子放电生成氢气,2H++2e-=H2↑,阳极反应为:Fe-2e-= Fe2+,根据此反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,可知1 molK2Cr2O7和6molFe2+反应,所以阳极每生成6molFe2+,失去12mol电子,根据得失电子守恒可知:阴极区生成氢气为6mol,标况下氢气的体积为:134.4L,故答案为:134.4。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案