题目内容
1.在氧化还原反应中,氧化过程和还原过程是同时发生的两个半反应.Cu2O-2e-+2H+═2Cu2++H2O是一个半反应式.下列五种物质FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI中的一种能使上述半反应顺利发生.(1)写出并配平该反应的离子方程式:Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+.
(2)向(1)中反应后的溶液里加入酸性高锰酸钾溶液,得还原产物Mn2+(无色),反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.判断Cu2+、MnO4-、Fe3+的氧化性由强到弱的顺序是MnO4-、Fe3+、Cu2+ (用离子符号表示).
(3)某同学用上述原理测定一种含Cu2O的矿石中Cu2O的质量分数:
称量5.0g矿石溶于足量的硫酸铁和硫酸的混合溶液中,充分反应后,用酸性高锰酸钾溶液滴定,消耗0.100 0mol•L-1的高锰酸钾溶液的体积为100.00mL.
①滴定时,滴定终点的颜色为无色变为紫红色,30秒内不褪色.
②该同学测得矿石样品中Cu2O的质量分数为72%.
③下列情况使测定结果一定偏高的是BD.
A.开始和终点都是仰视读数 B.没有用待装液润洗滴定管
C.称量时,砝码与样品放反了 D.样品中含有较强还原性杂质
E.高锰酸钾溶液中含有N03- F.用酸性高锰酸钾溶液润洗锥形瓶.
分析 (1)要使Cu2O-2e-+2H +═2Cu2++H2O能够发生反应,则需要加入氧化剂,氧化剂在反应中得电子化合价降低,FeSO4、Fe2(SO4)3、CuSO4、Na2CO3、KI中能氧化+2价铜的为Fe2(SO4)3,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,根据转移电子配平方程式;
(2)二价铁离子具有还原性能够还原酸性的高锰酸钾,依据氧化还原反应强弱规律:氧化剂氧化性大于氧化产物氧化性解答;
(3)①高锰酸根离子为紫红色,未达到滴定终点时,被还原为无色,当达到滴定终点时,无色变为紫红色,30秒内不褪色据此解答;
②依据方程式:2Fe3++Cu2O+2H+=2Fe2++Cu2++H2O、5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O中高锰酸钾和氧化亚铜之间的关系式计算解答;
③该实验为氧化还原反应滴定,依据方程式高锰酸钾与氧化亚铜的关系可知消耗高锰酸钾体积越大,氧化亚铜质量分数越大,反正越小,所以分析滴定过程中使用高锰酸钾溶液的体积偏大还是偏小即可解答.
解答 解:(1)反应Cu2O-2e-+2H+═2Cu2++H2O中失电子,所以另一个半反应中得电子,发生还原反应,根据提供的物质知,硫酸铁作氧化剂得电子生成硫酸亚铁,所以该反应的离子方程式为:Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+,故答案为:Cu2O+2H++2Fe3+=2Cu2++H2O+2Fe2+;
(2)亚铁离子有还原性,酸性条件下高锰酸根离子有强氧化性,所以二价亚铁离子和高锰酸根离子发生氧化还原反应生成铁离子和二价锰离子,离子方程式为:5Fe2++MnO4-+8H+=5 Fe3++Mn2++4H2O,该反应中高锰酸根离子的氧化性大于铁离子的氧化性,反应Cu2O+2H++Fe3+=2Cu2++H2O+Fe2+中铁离子氧化性大于铜离子,所以Cu2+、MnO4-、Fe3+的氧化性由强到弱的顺序MnO4-、Fe3+、Cu2+.
故答案为:5Fe2++MnO4-+8H+=5 Fe3++Mn2++4H2O;MnO4-、Fe3+、Cu2+;
(3)①高锰酸根离子为紫红色,未达到滴定终点时,被还原为无色,当达到滴定终点时,无色变为紫红色,30秒内不褪色;
故答案为:无色变为紫红色,30秒内不褪色;
②设氧化亚铜的物质的量为xmol,依据方程式:2Fe3++Cu2O+2H+=2Fe2++Cu2++H2O、5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O可知:
5Cu2O~2 MnO4-
5 2
x 0.1mol/L×0.1L
解得x=0.025mol,则氧化亚铜的质量=0.025mol×144g/mol=3.6g,
所以氧化亚铜的质量分数=$\frac{3.6g}{5.0g}$×100%=72%,
故答案为:72%;
③A.开始和终点都是仰视读数,开始和终点都是仰视读数,消耗高锰酸钾溶液的体积不变,所测结果不变,故A不选;
B.没有用待装液润洗滴定管,导致消耗高锰酸钾溶液体积偏大,结果偏大,故B选;
C.称量时,砝码与样品放反了,游码未动,药品质量和砝码质量相等,结果不变,故C不选;
D.样品中含有较强还原性杂质,导致消耗的高锰酸钾溶液体积偏大,结果偏大,故D选;
E.高锰酸钾溶液中含有N03- 硝酸根具有强的氧化性,能够氧化二甲铁离子,导致消耗的高锰酸钾溶液的体积偏小,结果偏小,故E不选;
F.用酸性高锰酸钾溶液润洗锥形瓶,导致消耗的酸性高锰酸钾的体积偏小,结果偏小,故F不选;
故选:BD.
点评 本题考查了氧化还原反应方程式书写、氧化性强弱判断、氧化还原反应滴定及有关方程式计算,题目难度中等,熟悉氧化还原反应规律、滴定实验原理,准确找出高锰酸钾与氧化亚铜之间的关系是解题关键,注意滴定误差分析的方法.

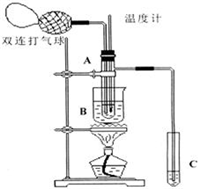 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇(甘油)(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为:
将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
| A. | NH3的水溶液可以导电,说明NH3是电解质 | |
| B. | Na2O2转变为Na2CO3时一定需要加入还原剂才能实现 | |
| C. | Fe2+、Cl2、SO2三种微粒既具有氧化性,又具有还原性 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3胶体>Fe(OH)3悬浊液>FeCl3溶液 |
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
| A. | 84消毒液(主要成分NaClO)与洁厕剂混合使用可能会导致中毒 | |
| B. | 晶体硅可用于光伏发电、制造芯片,硅酸钠可用于制备硅胶和木材防火剂;硅胶可用作袋装食品的干燥剂 | |
| C. | 小苏打可中和胃酸、热纯碱可除去油污 | |
| D. | 二氧化硫可广泛用于食品的增白及漂白纸浆、毛、丝、草帽辫等 |
| A. | 若1mL PH=1盐酸与100mL MaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11 | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH<7 | |
| C. | 某醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b | |
| D. | 1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0 |