题目内容
13.下列说法不正确的是( )| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
分析 A.氨气能使湿润的红色石蕊试纸变蓝;
B.硝酸根离子在酸性环境下具有强的氧化性;
C.铜与稀硝酸反应生成硝酸铜和NO和水;
D.稀硝酸与铜反应生成一氧化氮,一氧化氮氧化生成二氧化氮;
解答 解:A.氨气能使湿润的红色石蕊试纸变蓝,则其水溶液为氨水,显碱性,故A正确;
B.硝酸根离子在酸性环境下具有强的氧化性,能够氧化铜,所以铜会溶解,故B错误;
C.铜与稀硝酸反应生成硝酸铜和NO和水,离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.稀硝酸与铜反应生成一氧化氮,一氧化氮氧化生成二氧化氮,所以以上各步变化均能通过一步实现,故D正确;
故选:B.
点评 本题考查了元素化合物知识,熟悉氨气、硝酸、一氧化氮、二氧化氮的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
4.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2 HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | Ba(OH)2溶液中滴入少量的NaHSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
18.米易龙潭溶洞景区被誉为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2-就是一种空气负离子,其摩尔质量为( )
| A. | 32 g | B. | 33 g/mol | C. | 33 g | D. | 32 g/mol |
5.几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是( )
| 元素代号 | A | B | C | D | E | F | G | H |
| 化合价 | -1 | -2 | +4、-4 | +7、-1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能从GD2溶液中置换出D单质 | |
| B. | G在CB2中燃烧生成两种化合物 | |
| C. | E元素的单质不存在同素异形体 | |
| D. | A、F、H的离子半径由大到小顺序是A>H>F |
2.根据如图信息,下列说法正确的是( )
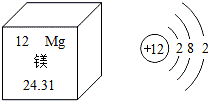

| A. | 镁原子的核电荷数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁属于非金属元素 | |
| D. | 在化学反应中,镁原子容易得到电子 |
3.要证明CuSO4溶液显蓝色不是由于SO42-离子造成的,下列实验无意义的是( )
| A. | 观察K2SO4溶液的颜色 | |
| B. | 向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失 | |
| C. | 加水稀释后CuSO4溶液颜色变浅 | |
| D. | 向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失 |
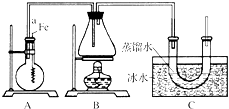 按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷: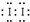 (用电子式表示).
(用电子式表示).