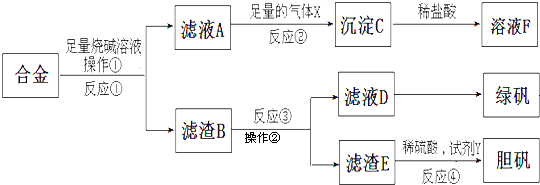
题目内容
6.下列有关叙述中正确的是( )| A. | NH3的水溶液可以导电,说明NH3是电解质 | |
| B. | Na2O2转变为Na2CO3时一定需要加入还原剂才能实现 | |
| C. | Fe2+、Cl2、SO2三种微粒既具有氧化性,又具有还原性 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3胶体>Fe(OH)3悬浊液>FeCl3溶液 |
分析 A、电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等,非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;
B、过氧化钠与二氧化碳反应,既是氧化剂也是还原剂;
C、处于中间价态的离子或原子团既具有氧化性又具有还原性;
D、浊液>100nm,溶液<1nm,据此解答即可.
解答 解:A、氨气本身不能电离,其溶于水导电的原因是生成一水合氨,氨气属于非电解质,故A错误;
B、过氧化钠与二氧化碳反应生成碳酸钠和氧气,故不需要还原剂,故B错误;
C、Fe2+、Cl2、SO2三种微粒都处于中间价态,既具有氧化性,又具有还原性,故C正确;
D、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故D错误,故选C.
点评 本题主要考查的是电解质与非电解质的概念、氧化剂与还原剂、分散系的分类,难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
17.一定温度下,1mol X和n mol Y在容积为2L的密闭容器中发生如下反应:X(g)+Y(g)?2Z(g)+M(s),5min后达到平衡,此时生成2amolZ,下列说法正确的是( )
| A. | 其他条件不变,向平衡后的体系中加入1mol M,平衡向逆反应方向移动 | |
| B. | 其他条件不变,向平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动 | |
| C. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| D. | 用X表示此反应的反应速率是(0.1-0.2a)mol•L-1min-1 |
18.米易龙潭溶洞景区被誉为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2-就是一种空气负离子,其摩尔质量为( )
| A. | 32 g | B. | 33 g/mol | C. | 33 g | D. | 32 g/mol |
16.若要检验酒精中是否含有少量水,可选用的试剂是M.制取无水酒精时,通常需向工业酒精中加入物质N,并加热蒸馏.则M、N分别应是( )
| A. | 生石灰、无水硫酸铜 | B. | 无水硫酸铜、浓硫酸 | ||
| C. | 无水硫酸铜、生石灰 | D. | 金属钠、生石灰 |
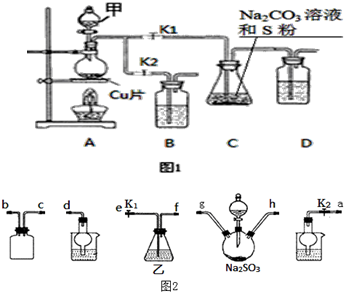
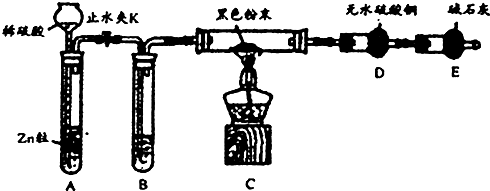
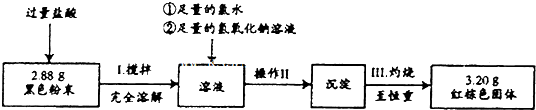
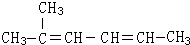 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.