题目内容
【题目】已知下列热化学方程式:
①H2O(l)=H2(g)+ ![]() O2(g) △H=+285.8 kJ/mol
O2(g) △H=+285.8 kJ/mol
②H2(g)+ ![]() O2(g)=H2O(g) △H=-241.8 kJ/mol
O2(g)=H2O(g) △H=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol
④C(s)+ ![]() O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
⑤C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
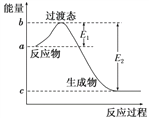
(1)上述反应中属于吸热反应的是____________________ 。
(2)C的燃烧热为____________________。
(3)燃烧10g H2生成液态水,放出的热量为______________。
(4)写出表示CO燃烧热的热化学方程式:__________________;写出制水煤气的热化学方程式:______________________。
【答案】 ① 393.5 kJ/mol 1429 kJ CO(g)+ ![]() O2(g) =CO2(g) △H=283.0 kJ/mol C(s)+H2O(g=CO(g)+H2(g) △H=+131.3 kJ/mol
O2(g) =CO2(g) △H=283.0 kJ/mol C(s)+H2O(g=CO(g)+H2(g) △H=+131.3 kJ/mol
【解析】试题分析:(1)吸热反应△H>0,因此①是吸热反应;(2)燃烧热:25℃时,1mol可燃物完全燃烧生成稳定氧化物所放出的热量,如C转化成CO2,H转化成液态水,因此⑤表示碳燃烧热的热化学反应方程式,即燃烧热:△H="-393.5" kJ/mol ;(3)②+①得出:H2O(l)=H2O(g) △H=+44kJ·mol-1⑥,②-⑥推出:H2(g)+1/2O2(g)=H2O(l) △H=-241.8-44kJ·mol-1=-285.8 kJ·mol-1,因此消耗10g氢气放出的热量为1429kJ;(4)⑤-④推出:CO(g)+1/2O2(g)=CO2(g) △H=-283.0kJ·mol-1;④-②得出:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ·mol-1。

【题目】对下列实验现象的解释不正确的是
选项 | 实验现象 | 解释 |
A | C12使鲜艳的红色花瓣褪色 | Cl2具有强还原性 |
B | NH3与HCl气体接触时有白烟产生 | NH3与HCl反应生成固体小颗粒 |
C | 新切开的Na表面在空气中很快变暗 | Na容易与空气中的氧气等反应 |
D | 氯化铝溶液中滴入过量的氢氧化钠溶液,白色沉淀溶解 | 氢氧化铝具有两性 |
A. A B. B C. C D. D