题目内容
【题目】有一瓶澄清的溶液,其中可能含有 H+、NH4+、Na+、Al3+、Fe3+、I-、NO3- 、CO32-、SO42- 、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③该溶液的焰色反应没有黄色;
④当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。
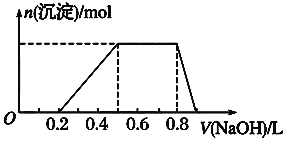
(1)该溶液中肯定含有的离子是_________________________,已确定阳离子的物质的量之比为_______________________。
(2)肯定不含的离子是_________________________________。
(3)不能确定的离子是_________,如何证明该离子是否存在?__________。
(4)请写出沉淀溶解过程的离子方程式____________________________。
【答案】H+、![]() 、Al3+、I-c(H+): c(
、Al3+、I-c(H+): c(![]() ) : c(Al3+)=2:3:1Na+、Fe3+、
) : c(Al3+)=2:3:1Na+、Fe3+、![]() 、
、![]() 、
、![]()
![]() 取溶液少量于试管中,向其中加入足量盐酸,无明显现象,再加几滴BaCl2溶液,产生白色沉淀,则证明含有
取溶液少量于试管中,向其中加入足量盐酸,无明显现象,再加几滴BaCl2溶液,产生白色沉淀,则证明含有![]() ,反之没有Al(OH)3+OH-=
,反之没有Al(OH)3+OH-= ![]() + 2H2O
+ 2H2O
【解析】
①.用pH试纸检测,溶液呈强酸性,说明溶液中存在H+,则一定不存在CO32-、AlO2-;②.取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色,说明溶液中一定含有I-,则一定不含有Fe3+、NO3-;③.该溶液的焰色反应没有黄色,则一定不含Na+;④.另取溶液适量,逐滴加入NaOH溶液,由图可知,先发生H++OH-=H2O,再发生Al3++3OH-= Al(OH)3↓,然后发生NH4++OH-=NH3·H2O,最后发生Al(OH)3+OH-=AlO2-+2H2O,则原溶液中含NH4+、Al3+。
(1).由上述分析可知,原溶液中一定含有H+、NH4+、Al3+、I,由H++OH-=H2O、Al3++3OH-= Al(OH)3↓、NH4++OH-=NH3·H2O并结合图象可知,消耗NaOH的体积分别为0.2L、0.3L、0.3L,阳离子的物质的量之比为c(H+):c(NH4+):c(Al3+)=2:3:1,故答案为:H+、NH4+、Al3+、I;c(H+):c(NH4+):c(Al3+)=2:3:1;
(2).由上述分析可知,溶液中肯定不含的离子是Na+、Fe3+、NO3、CO32、AlO2,故答案为:Na+、Fe3+、NO3、CO32、AlO2;
(3).根据上述分析,不能确定溶液中是否含SO42,证明该离子是否存在的实验方法为:取溶液少量于试管中,向其中加入足量盐酸,无明显现象,再加几滴BaCl2溶液,产生白色沉淀,则证明含有SO42,反之没有SO42,故答案为:SO42;取溶液少量于试管中,向其中加入足量盐酸,无明显现象,再加几滴BaCl2溶液,产生白色沉淀,则证明含有SO42,反之没有;
(4).沉淀溶解过程的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
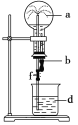
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4 mol/L NaHCO3溶液 |
C | Cl2 | 饱和NaCl水溶液 |
D | NH3 | 1 mol/L盐酸 |
A. AB. BC. CD. D



