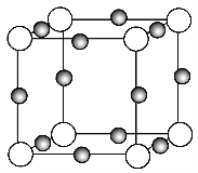
题目内容
【题目】NA为阿伏加德罗常数的值,下列叙述错误的是
A. 18g H2O中含的质子数为10NA
B. 12g 金刚石含有的共价键数为4NA
C. 28g N2中含有π键总数为2NA
D. 1 mol Na 与足量O2 反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
【答案】B
【解析】A项,1个H2O中含10个质子;B项,金刚石中n(C):n(C-C)=1:2;C项,N2的结构式为N![]() N,三键中含1个σ键和2个π键;D项,反应前后Na元素的化合价由0价升至+1价。
N,三键中含1个σ键和2个π键;D项,反应前后Na元素的化合价由0价升至+1价。
A项,n(H2O)=![]() =1mol,1个H2O中含10个质子,1molH2O中含10mol质子,A项正确;B项,n(C)=
=1mol,1个H2O中含10个质子,1molH2O中含10mol质子,A项正确;B项,n(C)=![]() =1mol,金刚石中n(C):n(C-C)=1:2,1mol金刚石中含共价键物质的量为2mol,B项错误;C项,n(N2)=
=1mol,金刚石中n(C):n(C-C)=1:2,1mol金刚石中含共价键物质的量为2mol,B项错误;C项,n(N2)=![]() =1mol,N2的结构式为N
=1mol,N2的结构式为N![]() N,三键中含1个σ键和2个π键,1molN2中含π键总数为2NA,C项正确;D项,Na与O2反应无论生成Na2O还是Na2O2,反应前后Na元素的化合价由0价升至+1价,1molNa参与反应失去1mol电子,D项正确;答案选B。
N,三键中含1个σ键和2个π键,1molN2中含π键总数为2NA,C项正确;D项,Na与O2反应无论生成Na2O还是Na2O2,反应前后Na元素的化合价由0价升至+1价,1molNa参与反应失去1mol电子,D项正确;答案选B。

【题目】向乙酸、乙醇、乙酸乙酯和水的平衡体系中加入少量含有18O的![]() ,达到新平衡后,体系中含有18O的物质是
,达到新平衡后,体系中含有18O的物质是
A. 乙酸、乙醇 B. 乙醇、乙酸乙酯
C. 乙醇、乙酸乙酯和水 D. 乙酸、乙醇、乙酸乙酯和水
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为____________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:_______________________;
(3)用电子式表示甲的形成过程:_____________________________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为________________;
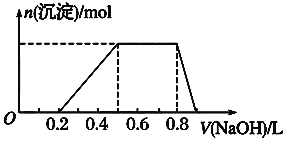
(5)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:____________mL。