题目内容
14.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2升密闭容器中进行1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )| A. | H2O:0.002 mol•L-1 | B. | NO:0.001 mol•L-1 | ||
| C. | NH3:0.002 mol•L-1 | D. | O2:0.0025 mol•L-1 |
分析 先根据V=△c△t=△nV△t计算出NH3表示的化学反应速率,再利用同一化学反应中,化学反应速率之比等于化学计量数之比对各选项进行判断.
解答 解:由1分钟后,NH3减少了0.12mol,则用NH3表示的化学反应速率为V(NH3)=V=△c△t=△nV△t=0.12mol2L60s=0.001mol•(L•s)-1,
A、由化学反应速率之比等于化学计量数之比,则v(H2O)=64v(NH3)=0.0015 mol•(L•s)-1,所以H2O平均每秒钟浓度变化为0.0015mol/L,故A错误;
B、由化学反应速率之比等于化学计量数之比,则v(NO)=v(NH3)=0.001 mol•(L•s)-1,所以NO平均每秒钟浓度变化为0.001 mol/L,故B正确;
C、因V(NH3)=0.001mol•(L•s)-1,所以NH3平均每秒钟浓度变化为0.001mol/L,故C错误;
D、由化学反应速率之比等于化学计量数之比,则v(O2)=54v(NH3)═0.00125 mol•(L•s)-1,所以O2平均每秒钟浓度变化为0.00125mol/L,故D错误;
故选:B.
点评 本题考查化学反应速率的计算,题目难度中等,注意明确同一化学反应中,用不同的物质来表示化学反应速率,数值不同但意义相同,且化学反应速率之比等于化学计量数之比.

练习册系列答案
相关题目
10.两种气态烃组成的混合气体0.1mol,完全燃烧得到0.16molCO2和3.6g水,下列说法错误的是( )
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烷 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中一定没有乙炔(C2H2) |
5.2011年3月11日福岛核电站遭受地震损坏而发生了核泄漏,其中核泄露的一种放射源是碘-131,下列说法不正确的( )
| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
9.漆酚 是我国特产漆的主要成分,下列叙述错误的是( )
是我国特产漆的主要成分,下列叙述错误的是( )
 是我国特产漆的主要成分,下列叙述错误的是( )
是我国特产漆的主要成分,下列叙述错误的是( )| A. | 能与FeCl3溶液发生显色反应,但不能发生加成反应 | |
| B. | 能和浓溴水发生取代反应,能与碳酸钠溶液反应生成CO2 | |
| C. | 可以使高锰酸钾溶液褪色 | |
| D. | 可以与甲醛发生缩聚反应 |
19.X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )
| A. | X的I1大于Y 的I1 | B. | X的电负性小于Y的电负性 | ||
| C. | X的阴离子半径小于Y的阳离子半径 | D. | X的原子半径大于Y的原子半径 |
6.下列说法中错误的是( )
| A. | 乙醇与金属钠反应时,是乙醇分子中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水可加入少量无水硫酸铜,若变蓝色则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 甲烷、乙烯、苯、乙酸都是无色不溶于水的有机化合物 |
4.某气态烃0.5mol能与1molHCl完全加成,加成后产物分子上的氢原子又可被4molCl2取代,则此气态烃可能是
( )
( )
| A. | CH≡CH | B. | CH≡CCH3 | C. | CH3C≡CCH3 | D. | CH2=C(CH3)CH3 |
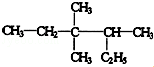 3,3,4-三甲基已烷分子结构中有1个手性碳原子.
3,3,4-三甲基已烷分子结构中有1个手性碳原子. ,
,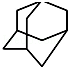 的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.
的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.