题目内容
19.X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,由此可知( )| A. | X的I1大于Y 的I1 | B. | X的电负性小于Y的电负性 | ||
| C. | X的阴离子半径小于Y的阳离子半径 | D. | X的原子半径大于Y的原子半径 |
分析 X的阴离子与Y的阳离子具有相同的电子层结构,X在Y的前一周期,可知原子半径、原子序数关系为Y>X,X为非金属,Y为金属,结合离子的性质解答该题.
解答 解:A.X为非金属元素不容易失去一个电子,Y为金属元素容易失去电子,所以X的第一电离能大于Y的第一电离能,故A正确;
B.X为非金属元素,Y为金属元素,所以X的电负性大于Y的电负性,故B错误;
C.X的阴离子与Y的阳离子具有相同的核外电子排布,核电荷数越大离子半径越小,故C错误;
D.X在Y的前一周期,则X的原子半径小于Y的原子半径,故D错误.
故选A.
点评 本题考查原子结构与元素周期律知识,题目难度中等,解答本题,根据原子结构的信息推断元素在周期表中的相对位置是解答该题的关键.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
15.下列表示物质结构的化学用语或模型图正确的是( )
| A. | 14C的原子结构示意图: | B. | 二氧化碳的电子式: | ||
| C. | H2O2的电子式: | D. | C3H8的结构式:CH3-CH2-CH3 |
10.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图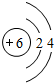 .
.
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为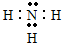 .
.
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
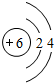 .
.(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
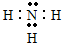 .
.(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
14.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2升密闭容器中进行1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A. | H2O:0.002 mol•L-1 | B. | NO:0.001 mol•L-1 | ||
| C. | NH3:0.002 mol•L-1 | D. | O2:0.0025 mol•L-1 |
4.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.

已知:各离子开始沉淀及完全沉淀时的pH如表所示.
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)物质A最好使用下列物质中的B.
A.KMnO4B.H2O2C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.

已知:各离子开始沉淀及完全沉淀时的pH如表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等).(任写一点即可)
(2)物质A最好使用下列物质中的B.
A.KMnO4B.H2O2C.HNO3
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(4)物质B可直接用作氮肥,则B的化学式是(NH4)2SO4.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能处理剂--K2FeO4,写出该反应的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
8.下列物质中,既有离子键又有共价键的是( )
| A. | CaCl2 | B. | KOH | C. | H2O | D. | HCl |
9.下列各组顺序的排列不正确的是( )
| A. | 金属性:Na>Mg>Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 碱性性强弱:NaOH>Mg(OH)2>Al(OH)3 | D. | 非金属性:F>Cl>S>O |
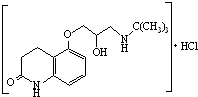 )可用于治疗心绞痛和青光眼.
)可用于治疗心绞痛和青光眼.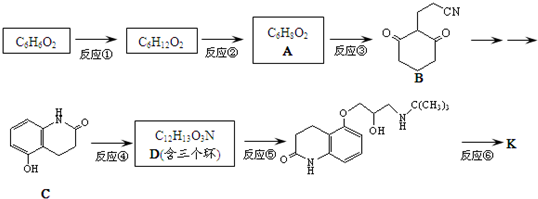
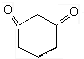 D
D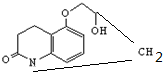
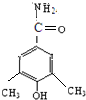
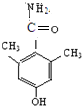 、
、
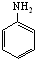 )与HNO2和H3PO2反应可得苯.请设计从C合成
)与HNO2和H3PO2反应可得苯.请设计从C合成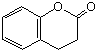 的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
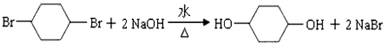 ;
;