题目内容
2.按要求填空:(1)分子中有18个氢原子的链烷烃的分子式:C8H18
(2)2,3-二甲基-1-丁烯的结构简式:CH2=C(CH3)CH(CH3)CH3
(3)用系统法命名:
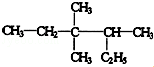 3,3,4-三甲基已烷分子结构中有1个手性碳原子.
3,3,4-三甲基已烷分子结构中有1个手性碳原子.(4)有机物的结构可用“键线式”简化表示.如CH3-CH=CH-CH3可简写为
 ,
,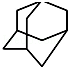 的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.
的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.
分析 (1)分子中有18个氢原子的链烷烃,符合CnH2n+2,确定分子式;
(2)碳碳双键在1号C上,2、3号C上有甲基,含双键C的主链有4个C;
(3) 中主链有6个C,3、4号C上有甲基,连四个不同基团的C为手性碳原子;
中主链有6个C,3、4号C上有甲基,连四个不同基团的C为手性碳原子;
(4) 中含4个CH、6个CH2,结合分子式及燃烧通式可知消耗氧气为1mol×(10+$\frac{16}{4}$).
中含4个CH、6个CH2,结合分子式及燃烧通式可知消耗氧气为1mol×(10+$\frac{16}{4}$).
解答 解:(1)分子中有18个氢原子的链烷烃,符合CnH2n+2,则2n+2=18,解得n=8,即分子式为C8H18,故答案为:C8H18;
(2)2,3-二甲基-1-丁烯中,碳碳双键在1号C上,2、3号C上有甲基,含双键C的主链有4个C,其结构简式为CH2=C(CH3)CH(CH3)CH3,故答案为:CH2=C(CH3)CH(CH3)CH3;
(3) 中主链有6个C,3、4号C上有甲基,名称为3,3,4-三甲基已烷;只有含1个H的C为手性碳,故答案为:3,3,4-三甲基已烷;1个;
中主链有6个C,3、4号C上有甲基,名称为3,3,4-三甲基已烷;只有含1个H的C为手性碳,故答案为:3,3,4-三甲基已烷;1个;
(4) 中含4个CH、6个CH2,分子式为C10H16;消耗氧气为1mol×(10+$\frac{16}{4}$)×22.4L/mol=313.6L,故答案为:C10H16;313.6.
中含4个CH、6个CH2,分子式为C10H16;消耗氧气为1mol×(10+$\frac{16}{4}$)×22.4L/mol=313.6L,故答案为:C10H16;313.6.
点评 本题考查有机物的结构与性质,为高频考点,综合性较强,涉及分子式确定、命名、手性碳原子判断及燃烧耗氧的计算等,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
18.在C6H14的各种同分异构体中,所含甲基数目和它的一氯取代物的数目与下列叙述相符的是( )
| A. | 2个-CH3,能生成4种一氯代物 | B. | 3个-CH3,能生成3种一氯代物 | ||
| C. | 3个-CH3,能生成5种一氯代物 | D. | 4个-CH3,能生成4种一氯代物 |
19.下列说法正确的是( )
| A. | 如图所示 表示乙醇的比例模型 表示乙醇的比例模型 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |
10.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图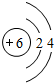 .
.
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为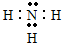 .
.
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
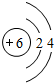 .
.(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
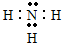 .
.(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
17.下列事实不能用电化学原理解释的是( )
| A. | 常温条件下,在空气中铝不容易被腐蚀 | |
| B. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| C. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| D. | 远洋海轮的尾部装上一定数量的锌板 |
14.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2升密闭容器中进行1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A. | H2O:0.002 mol•L-1 | B. | NO:0.001 mol•L-1 | ||
| C. | NH3:0.002 mol•L-1 | D. | O2:0.0025 mol•L-1 |
12.在一定温度下,反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 单位时间内生成n molA2同时生成n mol AB3 | |
| B. | 容器内的总物质的量不随时间变化 | |
| C. | 单位时间内生成2n mol AB3的同时生成n molB2 | |
| D. | 单位时间内生成n molA2的同时生成n molB2 |
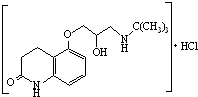 )可用于治疗心绞痛和青光眼.
)可用于治疗心绞痛和青光眼.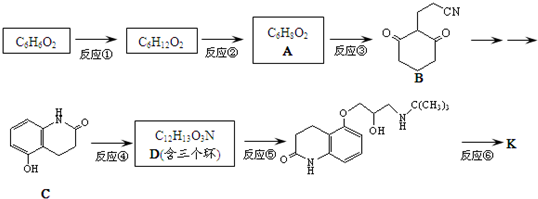
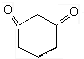 D
D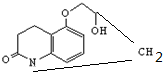
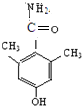 、
、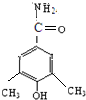
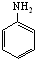 )与HNO2和H3PO2反应可得苯.请设计从C合成
)与HNO2和H3PO2反应可得苯.请设计从C合成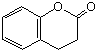 的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的路线.(合成路线常用的表示方法为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
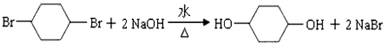 ;
;