题目内容
5.2011年3月11日福岛核电站遭受地震损坏而发生了核泄漏,其中核泄露的一种放射源是碘-131,下列说法不正确的( )| A. | 碘-131原子核外有5个电子层 | |
| B. | 碘-131原子的最外层有7个电子 | |
| C. | 具有放射性的碘-131原子比普通碘-127原子多4个中子 | |
| D. | 131I2与127I2互为同位素 |
分析 碘的原子结构示意图为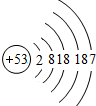 ,在原子中,核内质子数=核电荷数=核外电子数,质量数=质子数+中子数,以此解答该题.
,在原子中,核内质子数=核电荷数=核外电子数,质量数=质子数+中子数,以此解答该题.
解答 解:碘的原子结构示意图为 .
.
A.碘原子核外有5个电子层,故A正确;
B.碘原子的最外层有7个电子,故B正确;
C.碘元素的质子数相等,中子数之差=质量数之差=131-127=4,故C正确;
D.131I2与127I2是单质,同位素为原子,故D错误.
故选D.
点评 本题考查原子结构,为高频考点,明确质子数、中子数、核外电子数及其相互联系是解题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.工业通过氨的催化氧化制取硝酸,其中一个反应3NO2(g)+H2O(l)?2HNO3(aq)+NO(g)△H<0,现欲提高反应物NO2的转化率,增加硝酸的产量,下列采取的措施可行的是( )
| A. | 增加压强 | B. | 加大水量 | C. | 升高温度 | D. | 加入催化剂 |
19.下列说法正确的是( )
| A. | 如图所示 表示乙醇的比例模型 表示乙醇的比例模型 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也不存在同分异构体 | |
| D. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 |
6.为测定某碳酸氢钠固体的纯度(杂质为氯化钠).称取10.0g此样品至于烧杯中,滴加稀盐酸,测得反应过程中烧杯和药品的总质量随时间的变化数据如下(t0为起始时间):
计算:
(1)反应结束时,收集到CO2的体积(标准状况下);
(2)该样品中NaHCO3的质量分数.
| 反应时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯和药品的总质量/g | 210.0 | 206.8 | 205.9 | 205.7 | 205.6 | 205.6 | 205.6 |
(1)反应结束时,收集到CO2的体积(标准状况下);
(2)该样品中NaHCO3的质量分数.
10.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
(1)上述元素A、B、D、E、F中形成化合物种类最多的一种元素的原子结构示意图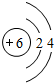 .
.
(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为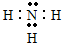 .
.
(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
| A | B | ||||||
| D | E | F | |||||
| C | I | G | H |
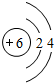 .
.(2)稳定性比较:D的氢化物>G的氢化物(填“大于”“等于”或“小于).
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
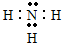 .
.(4)现有上表中所列字母代表的某一种元素,其单质通入到紫色石蕊溶液中的现象为先变红后褪色,写出有关的离子方程式Cl+H2O?H++Cl-+HClO.
(5)“神舟”七号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,该物质应该是由上表中的元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2═2Na2CO3+O2.
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为N≡N.
(6)发射飞船的火箭可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知32g肼和二氧化氮完全反应时放出的热量为567.85kJ;写出肼与二氧化氮反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-567.85kJ/mol.
17.下列事实不能用电化学原理解释的是( )
| A. | 常温条件下,在空气中铝不容易被腐蚀 | |
| B. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| C. | 镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀 | |
| D. | 远洋海轮的尾部装上一定数量的锌板 |
14.反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2升密闭容器中进行1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A. | H2O:0.002 mol•L-1 | B. | NO:0.001 mol•L-1 | ||
| C. | NH3:0.002 mol•L-1 | D. | O2:0.0025 mol•L-1 |
15.下列离子方程式书写正确的是( )
| A. | 碳酸氢钠和稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| D. | FeCl2溶液跟氯气反应:2Fe2++Cl2=2 Fe3++2Cl- |
 NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.