题目内容
【题目】镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
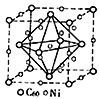
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
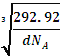
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。
【答案】 第四周期,第Ⅷ族 2 Ni(CO)4属于分子晶体,分子间以范德华力结合,较弱,容易被破坏 1∶1 CN- (或C22-) sp3杂化 2 Ni3C60 91∶6 ![]() ×
× ×1010或
×1010或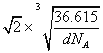 ×1010
×1010
【解析】(1)Ni的原子数序为28,位于周期表第四周期第Ⅷ族,原子核外电子排布为1s22s22p63s23p63d84s2,3d能级有2个未成对的电子;(2)①Ni(CO)4属于分子晶体,分子间以范德华力结合,较弱,容易被破坏,故其熔、佛点较低;②Ni(CO)4分子中含有4+4=8个σ键和![]() 个π键,所以其数目之比为1:1;③CO为2原子分子,电子数为14,对应的等电子体为CN- 或C22- ;④NH3中N原子形成3个δ键,孤电子对数为
个π键,所以其数目之比为1:1;③CO为2原子分子,电子数为14,对应的等电子体为CN- 或C22- ;④NH3中N原子形成3个δ键,孤电子对数为![]() =1,则为sp3杂化;氨气中含有氢键,易液化,且汽化时吸收大量的热,可用于制冷剂,对应的同分异构体中,正八面体的两个顶点可以是CO或NH3,有2中结构;(3)该晶胞中Ni原子的个数为12×
=1,则为sp3杂化;氨气中含有氢键,易液化,且汽化时吸收大量的热,可用于制冷剂,对应的同分异构体中,正八面体的两个顶点可以是CO或NH3,有2中结构;(3)该晶胞中Ni原子的个数为12×![]() +8+1=12;在该晶胞中含有的C60的个数是:8×
+8+1=12;在该晶胞中含有的C60的个数是:8×![]() +6×
+6×![]() =4,n(Ni):n(C60)=12:4=3:1,所以该材料的化学式为Ni3C60;(4)设1mol Ni0.97O中含Ni2+xmol,Ni3+ (0.97-x)mol,根据晶体仍呈中性,可知2x+3(0.97-x)=2
=4,n(Ni):n(C60)=12:4=3:1,所以该材料的化学式为Ni3C60;(4)设1mol Ni0.97O中含Ni2+xmol,Ni3+ (0.97-x)mol,根据晶体仍呈中性,可知2x+3(0.97-x)=2![]() ,x=0.91mol,(0.97-x)mol=0.06mol,即晶体中Ni2+与Ni3+离子的数目之比为0.91mol:0.06mol=91:6;每个晶胞中氧原子个数为4,镍原子个数为4,若阿伏伽德罗常数的值为NA,晶体密度为d g·cm-3,则晶胞的体积为V=
,x=0.91mol,(0.97-x)mol=0.06mol,即晶体中Ni2+与Ni3+离子的数目之比为0.91mol:0.06mol=91:6;每个晶胞中氧原子个数为4,镍原子个数为4,若阿伏伽德罗常数的值为NA,晶体密度为d g·cm-3,则晶胞的体积为V=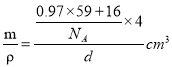 =
=![]() ,晶胞的边长为
,晶胞的边长为 cm=
cm=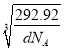 ×1010 pm,该晶胞中最近的O2-之间的距离为边长的
×1010 pm,该晶胞中最近的O2-之间的距离为边长的![]() 倍,故为
倍,故为![]() ×
×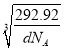 ×1010 pm。
×1010 pm。

【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5 , 反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50s的平均速率v(Cl2)=0.0016 molL﹣1min﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 molL﹣1 , 则该反应的△H<0
C.温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2 , 反应达到平衡前v(正)<v(逆)
D.温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2 , 达到平衡时,PCl3的转化率小于80%
【题目】三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:

有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)仪器a的名称是_____,装置A中发生反应的化学方程式为____________。
(2)B装置的作用除观察O2的流速之外。还有____________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是____________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液40.00mL,使Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是_______(填标号),滴定終点的现象为_____________。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②C1元素的质量百分含量为(列出算式)____________。
③步骤III加入硝基苯的目的是___,如无此操作,所测C1元素含量将会___(填“偏大”“偏小”或“不变”)。
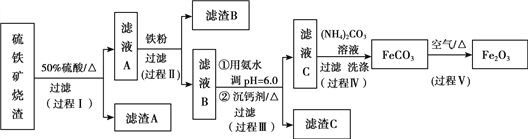
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
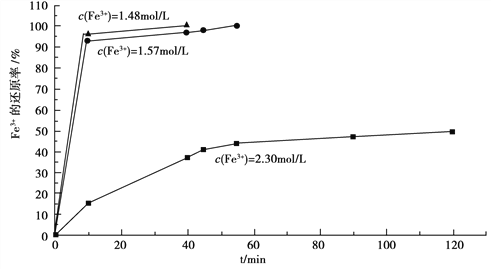
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。