��Ŀ����
18��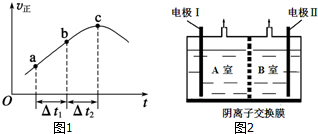 �����仯�����ת������Դ���úͻ�����������Ҫ�о����⣬�����ǵ���������ļ��ֲ�ͬ����µ�ת����
�����仯�����ת������Դ���úͻ�����������Ҫ�о����⣬�����ǵ���������ļ��ֲ�ͬ����µ�ת������1����֪��2SO2��g��+O2 ��g��?2SO3 ��g����H=-196.6kJ•mol-1
2NO��g��+O2 ��g��?2NO2 ��g����H=-113.0kJ•mol-1 ��SO2������NO2���巴Ӧ����SO3�����NO����ķ�ӦΪ���ȣ�����ȡ������ȡ�����Ӧ��
��2������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��ӦSO2��g��+NO2��g��?SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ��ͼ1��ʾ��
�ٷ�Ӧ��c��δ���ﵽ����δ������ƽ��״̬��
�ڿ�ʼʱ���ڸ������м��룺
��1molSO2��g����1molNO2��g����II��1molSO3��g����1mol NO��g������ﻯѧƽ��ʱ���÷�Ӧ��ƽ�ⳣ�������������=����������
��3��������������Һ���յ���������ʱ�������з�Ӧ��
2NaOH+NO+NO2=2NaNO2+H2O
2NaOH+2NO2=NaNO2+NaNO2+H2O
����Ӧ���Һ������������Һ�ֱ�ӵ���ͼ2��ʾ�ĵ����н��е�⣬A�Ҳ�����N2��
�ٵ缫����������B�Ҳ�����������O2��
��A��NO2-�����ĵ缫��Ӧ��2NO2-+6e-+4H2O=8OH-+N2����
��4��NH3����ԭ�������SCR��������ĿǰӦ����㷺���������������ѳ�����������NO��NO2�Ļ����6L������ͬ��ͬѹ��7L��NH3ǡ��ʹ����ȫת��ΪN2����ԭ���������NO��NO2�����ʵ���֮��Ϊ1��3��
���� ��1������������������Ӧ�����Ҫ���Ŀ�귴Ӧ����������Ӧ����������������Ӧ�ļӼ���Ŀ�귴Ӧ����Ӧ������Ӧ�ı仯���ɣ�
��2���ٷ�Ӧ��ƽ��ĸ�����־��V��=V������c���ֻ��V�������ѣ�
���������ݾ��ȣ�SO2��g��+NO2��g��?NO��g��+SO3 ��g����H��0����Ӧ���ȣ����ڸ������м��룺��1molSO2��g����1molNO2��g������ʼ��Ӧ���ȣ����������м���II��1molSO3��g����1mol NO��g������ʼʱ��Ӧ���ȣ��ݴ˷���ƽ�ⳣ����
��3��ͨ��A�Ҳ�����N2����֪A���ĵ������ҺΪNaNO3��NaNO2�Ļ����Һ��NO2-��A���ŵ�ΪN2����AΪ��������B��Ϊ�������������ҺΪNaOH��Һ��OH-��B���ŵ磬�ݴ˷�����
��4�����NO�����ΪXL��NO2�����ΪYL������X+Y=6 ��
Ȼ����ݺͰ�����Ӧʱ��ʧ�������غ���У�2X+4Y=7��3 ��
����ʽ�������ɽ�ã�
��� �⣺��1����֪��2SO2��g��+O2 ��g��?2SO3 ��g����H=-196.6kJ•mol-1 ��
2NO��g��+O2 ��g��?2NO2 ��g����H=-113.0kJ•mol-1 ��
��$\frac{��}{2}-\frac{��}{2}$�ɵã�SO2��g��+NO2��g��?NO��g��+SO3 ��g����H=$\frac{-196.6KJ/mol}{2}$-$\frac{-113.0KJ/mol}{2}$=-41.6KJ/mol��������Ӧ�ȡ�H��0ʱ����Ӧ���ȣ�
�ʴ�Ϊ�����ȣ�
��2���ٻ�ѧƽ��״̬�ı�־�Ǹ����ʵ�Ũ�Ȳ��ٸı䣬��ʵ��������Ӧ���ʵ����淴Ӧ���ʣ�c���Ӧ������Ӧ������Ȼ���ڸı䣬��һ��δ��ƽ�⣬
�ʴ�Ϊ��δ�
���������ݾ��ȣ�SO2��g��+NO2��g��?NO��g��+SO3 ��g����H��0����Ӧ���ȣ����ڸ������м��룺��1molSO2��g����1molNO2��g������ʼ��Ӧ���ȣ��¶�����ƽ�����ƣ�K��С�����������м���II��1molSO3��g����1mol NO��g������ʼʱ��Ӧ���ȣ��¶Ƚ���ƽ�����ƣ�K���ʸ÷�Ӧ��ƽ�ⳣ����
�ʴ�Ϊ������
��3��ͨ��A�Ҳ�����N2����֪I���ĵ������ҺΪNaNO3��NaNO2�Ļ����Һ��NO2-��I�ŵ�ΪN2����AΪ��������II��Ϊ�������������ҺΪNaOH��Һ��OH-��II���ŵ磮
�ٵ缫IΪ����������B��ΪNaOH��Һ����II��Ϊ����������II���ŵ������������4OH--4e-=O2��+2H2O��������������Ϊ�������ʴ�Ϊ��������O2��
��NO2-�������õ��ӱ���ԭΪ���������B�ҵ���Һ��������Һ���ʷŵ�ķ���ʽΪ��2NO2-+6e-+4H2O=8OH-+N2�����ʴ�Ϊ��2NO2-+6e-+4H2O=8OH-+N2����
��4�����NO�����ΪXL��NO2�����ΪYL�����ݻ����������Ϊ6L������X+Y=6 ��
������Ӧʱ��NO��NO2�õ��ӣ�������ʧ���ӣ����ݵ�ʧ�������غ���У�2X+4Y=7��3 ��
����ʽ�������ɽ��X=1.5��Y=4.5������X��Y=1��3���ʴ�Ϊ��1��3��
���� ���⿼���˸�˹���ɵ�Ӧ�á���ѧƽ�ⳣ���Ĵ�С�Ƚ��Լ��绯ѧ֪ʶ�����ã��ۺ��Խ�ǿ���Ѷ����У�

| A�� | ��ϩ�;���ϩ���ܺ���ˮ�����ӳɷ�Ӧ��ʹ��ˮ��ɫ | |
| B�� | �������Ⱥ����Ȼ���������������ˮ�Ĵ��������ߵ�����ԭ����ͬ | |
| C�� | Ksp���������ܵ���ʵ����ʺ��¶��йأ����һ�����Һ�е�����Ũ���й� | |
| D�� | 7.8g�������ƺ��еĹ��õ��Ӷ���Ϊ0.1NA |
| A�� | ����Ƭ����������ϼ��Ƚ������ȷ�Ӧ | |
| B�� | ����������ˮ�����ȼ����Ӻ��ټ����������Ƶ�Cu��OH��2�Ϳ�ʵ�ֽ�����ˮ�⣬�������Ƶ�Cu��OH��2�������ǵ�ˮ����� | |
| C�� | ��������Ȼ�̼��Һ���ܼ�����������ϩ | |
| D�� | ���ѻ������м������Ը��������Һ������ɫ��ȥ˵�������к��мױ��ȱ���ͬϵ�� |
| A�� | ��ʯ������ˮ��Ӧ���������������� | |
| B�� | �Ȼ�����һ�ֵ���ʣ������ڵ�ⷨ���� | |
| C�� | Һ������ʱҪ���մ������ȣ������������ | |
| D�� | �������費��ǿ�ᷴӦ������ʯӢ����ʢ������� |
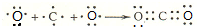 ��
��
 ��
�� ��
�� ��
��
 ��
��
 ��
�� ��
��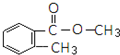 ��
��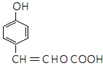 ��
�� 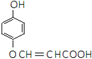 ���ڡ��䡢�Ե�����һ�֣�
���ڡ��䡢�Ե�����һ�֣� �о����������仯�������������Ҫ���壮
�о����������仯�������������Ҫ���壮