题目内容
7.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )| A. | S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 | |
| D. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1;2CO(g)+O2(g)═2CO2(g)△H2 |
分析 A、对于放热反应,当产物相同时,反应物的能量越高,放出的热量越多;
B、对于放热反应,当反应物相同时,产物的能量越低,放出的热量越多;
C、反应热与物质的计量数成正比;
D、反应热与物质的计量数成正比.
解答 解:A、S的燃烧为放热反应,且相同物质的量的硫蒸汽的能量高于固体硫的能量,而对于放热反应,当产物相同时,反应物的能量越高,放出的热量越多,△H越小,所以△H1>△H2,故A错误;
B、氢气的燃烧是放热反应,且相同物质的量的水蒸气的能量高于液态水的能量,对于放热反应,当反应物相同时,产物的能量越低,放出的热量越多,△H越小,故有△H1>△H2,故B错误;
C、化合反应为放热反应,△H为负值,而由于反应热与物质的计量数成正比,故反应1放出的热量大于反应2,则△H1<△H2,故C正确;
D、CO的燃烧为放热反应,△H为负值,而由于反应热与物质的计量数成正比,故反应1放出的热量小于反应2,则△H1>△H2,故D错误;
故选C.
点评 本题考查了物质反应能量变化分析判断,主要是盖斯定律的应用,物质量不同、状态不同、产物不同,反应的能量变化本题,题目较简单.

练习册系列答案
相关题目
18.下列说法不正确的是( )
| A. | Na2O、Na2O2组成元素相同,均与H2O反应,均属于碱性氧化物 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈无色 | |
| C. | NO、SO2、NO2都是大气污染气体,在空气中都不能稳定存在 | |
| D. | SiO2是酸性氧化物,能与NaOH溶液反应 |
15.提纯下列物质(括号内为杂质),选用的除杂试剂与分离方法正确的是( )
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 苯(Br2) | KOH溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法一定不正确的是( )
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 113号元素属于过渡元素 |
12.一定量的镁铝合金与375mL2mol/L的HNO3完全反应生成3.36LNO(标准状态)和镁盐、铝盐等,再向反应后的溶液中加入3mol/LNaOH溶液,使镁、铝元素完全沉淀下来,则所加入氢氧化钠溶液的体积是( )
| A. | 150mL | B. | 200mL | C. | 450mL | D. | 无法计算 |
19.已知C(s)+CO2(g)?2CO(g)正反应方向是吸热过程,下列可使正反应速率增大的措施是( )
①减小容器体积使增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥降低温度.
①减小容器体积使增大压强
②增加碳的量
③恒容时通入CO2
④恒压下充入N2
⑤恒容下充入N2
⑥降低温度.
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ①③⑥ |
16.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
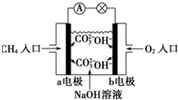

| A. | a极是负极,发生氧化反应 | |
| B. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| C. | 该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O | |
| D. | 甲烷燃料电池是环保电池 |
17.下列变化中,不破坏化学键的是( )
| A. | HCl溶于水 | B. | 碘的升华 | C. | 水的电解 | D. | 金刚石熔化 |