题目内容
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
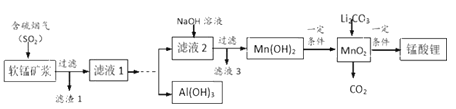
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
【答案】降低通入含硫烟气的温度(或减小通入含硫烟气的流速) Al3+、Fe2+ MnO2对Li2CO3分解有催化作用 4MnO2![]() 2Mn2O3 +O2↑ 2Li2O + 4Mn2O3 + O2
2Mn2O3 +O2↑ 2Li2O + 4Mn2O3 + O2 ![]() 4LiMn2O4 滴加足量H2O2;搅拌,加入NaOH溶液至4.7≤pH<7.7,过滤得滤液2和固体;向所得固体中加入NaOH溶液至pH≥12,搅拌、过滤,再向所得滤液中通入过量的CO2,过滤、洗涤、低温烘干得Al(OH)3
4LiMn2O4 滴加足量H2O2;搅拌,加入NaOH溶液至4.7≤pH<7.7,过滤得滤液2和固体;向所得固体中加入NaOH溶液至pH≥12,搅拌、过滤,再向所得滤液中通入过量的CO2,过滤、洗涤、低温烘干得Al(OH)3
【解析】
软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等)制备锰酸锂,在实际生产中,Li2CO3与MnO2按物质的量之比为1:4混合均匀加热制取LiMn2O4.软锰矿浆通入含二氧化硫的烟气,二氧化硫溶于水生成亚硫酸,MnO2、Fe2O3、FeO、Al2O3、都能溶于酸,二氧化硅不溶盐酸,滤渣1为二氧化硅,滤液1含Al3+、Mn2+、Fe2+,滴加足量过氧化氢,搅拌加入氢氧化钠溶液至4.7≤PH<7.7,过滤得到滤液2和固体,向所得固体中加入氢氧化钠溶液至PH≥12,搅拌过滤再向所得滤液中通入二氧化碳过滤洗涤,低温烘干得到氢氧化铝,滤液2中加入氢氧化钠溶液过滤得到Mn(OH)2,一定条件下得到MnO2,Li2CO3与MnO2按物质的量之比为1:4混合均匀加热制取LiMn2O4.
(1)图象分析可知随温度升高,二氧化硫的吸收率降低。
(2)烟气中含二氧化硫溶于水生成亚硫酸,溶液显酸性,二氧化硅是酸性氧化物不与亚硫酸反应,氧化铝是两性氢氧化物,氧化铁和氧化亚铁是碱性氧化物,且铁离子具有氧化性把二氧化硫氧化为硫酸而本身被还原为亚铁离子,二氧化锰中+4价锰被还原为Mn2+。
(3)①考虑二氧化锰的催化剂作用。
②升温到566℃时,MnO2开始分解产生另一种气体X只能为氧气,氧气恰好与①中产生的CO2物质的量相等,假设Li2CO3的物质的量为1mol,MnO2物质的量为4mol,则产生1molCO2即生成1molO2,元素守恒B中含4molMn和6molO,同时得到固体B的化学式Mn2O3。
③升温到720℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂,Li2O和Mn2O3反应生成LiMn2O4。
(4)依据(2)分析含有的离子是Al3+、Fe2+等,根据流程图锰离子存在在溶液中,需要把铁离子和铝离子沉淀不能影响锰离子,据表中数据分析,把亚铁离子氧化为铁离子,然后调节溶液PH,使铁离子、铝离子完全沉淀,再利用氢氧化铝的两性除去氢氧化铁。
(1)图象分析可知随温度升高,二氧化硫的吸收率降低,因此提高二氧化硫吸收率需要降低通入含硫烟气的温度或减小通入含硫烟气的流速。故答案为:降低通入含硫烟气的温度(或减小通入含硫烟气的流速);
(2)烟气中含二氧化硫溶于水生成亚硫酸,溶液显酸性,二氧化硅是酸性氧化物不与亚硫酸反应,氧化铝是两性氢氧化物,氧化铁和氧化亚铁是碱性氧化物,且铁离子具有氧化性把二氧化硫以为硫酸本身被还原为亚铁离子,二氧化锰中+4价锰被还原为Mn2+,因此滤液1中含有的金属阳离子是Al3+、Mn2+、Fe2+。故答案为:Al3+、Fe2+;
(3)①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,说明MnO2对Li2CO3的分解有催化剂的作用。
②升温到566℃时,MnO2开始分解产生另一种气体X只能为氧气,氧气恰好与①中产生的CO2物质的量相等,假设Li2CO3的物质的量为1mol,MnO2物质的量为4mol,则产生1molCO2即生成1molO2,元素守恒B中含4molMn和6molO,同时得到固体B的化学式Mn2O3,反应的化学方程式为:![]() 。
。
③升温到720℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂,Li2O和Mn2O3反应生成LiMn2O4,因为固体质量增加,反应的化学方程式为:![]()
故答案为:MnO2对Li2CO3分解有催化作用;![]() ;
;![]() ;
;
(4)依据(2)分析含有的离子是Al3+、Fe2+等,根据流程图锰离子存在在溶液中,需要把铁离子和铝离子沉淀不能影响锰离子表中数据分析,把亚铁以为铁离子,然后调节溶液PH,使铁离子、铝离子完全沉淀,再利用氢氧化铝的两性除去氢氧化铁,具体步骤为:滴加足量过氧化氢,搅拌加入氢氧化钠溶液至4.7≤pH<7.7,过滤得到滤液2和固体,向所得固体中加入氢氧化钠溶液至
故答案为:滴加足量H2O2;搅拌,加入NaOH溶液至4.7≤pH<7.7,过滤得滤液2和固体;向所得固体中加入NaOH溶液至pH≥12,搅拌、过滤,再向所得滤液中通入过量的CO2,过滤、洗涤、低温烘干得Al(OH)3。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案