题目内容
【题目】环丁基甲酸(![]() )常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
)常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
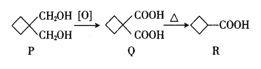
A.R与乙酸互为同系物
B.P、Q、R均能与金属钠反应
C.Q中所有碳原子不可能共平面
D.P的同分异构体中能与NaHCO3溶液反应的结构共有8种(不考虑立体异构)
【答案】A
【解析】
A选项,R与乙酸结构不相似,R有环状结构,因此不是同系物,故A错误;
B选项,P含有羟基,与钠反应,Q、R含有羧基,与钠反应,故B正确;
C选项,Q中![]() ,*号碳原子与周围的四个碳原子形成四面体结构,因此所有碳原子不可能共平面,故C正确;
,*号碳原子与周围的四个碳原子形成四面体结构,因此所有碳原子不可能共平面,故C正确;
D选项,P的同分异构体中能与NaHCO3溶液反应,说明含有羧基,含有—COOH的同分异构有![]() ,该结构中有3种,
,该结构中有3种,![]() ,该结构中有4种,
,该结构中有4种,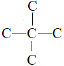 ,该结构有1种,共8种结构,故D正确。
,该结构有1种,共8种结构,故D正确。
综上所述,答案为A。

 名校课堂系列答案
名校课堂系列答案【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
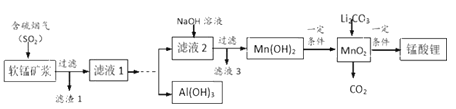
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)