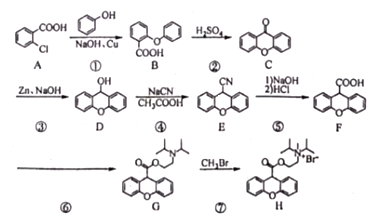
题目内容
【题目】可用于电动汽车的铝—空气燃料电池,若以氢氧化钠溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.正极反应式为![]()
B.负极反应式为![]()
C.电池在工作过程中电解液的碱性保持不变
D.电池工作时,电子通过外电路从正极流向负极
【答案】A
【解析】
铝空气氢氧化钠燃料电池中负极反应为Al+4OH---3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH-+3O2═4AlO2-+2H2O,据此分析解答。
A.电解质溶液显碱性,该燃料电极的正极发生反应为:O2 +2H2O+4e-=4OH-,故A正确;
B.铝作负极,负极是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4OH--3e-=AlO2-+2H2O,故B错误;
C.该电池在碱性条件下消耗了碱,总反应为4Al+3O2+4OH-=4AlO2-+2H2O,溶液的碱性减弱,故C错误;
D.电池工作时,电子从负极出来经过外电路流到正极,故D错误;
故选A。

【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
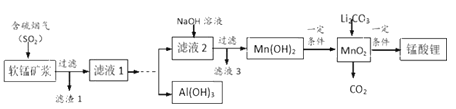
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)