题目内容
7.下列关于丙烯(CH3-CH═CH2)的说法正确的( )| A. | 丙烯分子有8个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子中只存在极性键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
分析 A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
B.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
C.同种非元素之间形成非极性键;
D.由C=C双键为平面结构、甲基为四面体结构分析.
解答 解:A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A正确;
B.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,则丙烯分子中1个碳原子是sp3杂化,2个碳原子是sp2杂化,故B错误;
C.同种非元素之间形成非极性键,则丙烯中存在C-C非极性共价键,故C错误;
D.由C=C双键为平面结构、甲基为四面体结构可知,丙烯分子中2个碳原子在同一直线,故D错误;故选A.
点评 本题考查共价键及分类,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
18.下列各组中,顺序排列错误的是( )
| A. | 离子半径:O2->Na+>Mg2+>Al3+>F- | |
| B. | 热稳定性:HCl>H2S>PH3>AsH3 | |
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4<H2SO4 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
2.下列操作中,若以标准溶液滴定待测液,能造成中和滴定结果偏低的是( )
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排出就开始滴定,滴定后气泡消失 | |
| C. | 锥形瓶用蒸馏水洗,未用待测液润洗 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
17.下列物质中,一氯代物的同分异构体有2种的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 正戊烷 | D. | 新戊烷 |
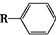 $→_{一定条件}^{CO,HCl}$
$→_{一定条件}^{CO,HCl}$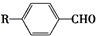 ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: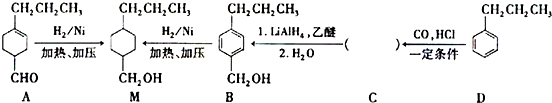
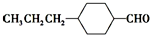 和
和 (写结构简式)生成.
(写结构简式)生成.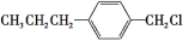 .
.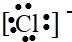 ,C.H2O
,C.H2O ,D.Na2O2
,D.Na2O2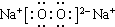 ,
, ;MgCl2
;MgCl2 .
.

 ;B的原子在周期表中的位置是第三周期ⅡA族
;B的原子在周期表中的位置是第三周期ⅡA族