题目内容
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
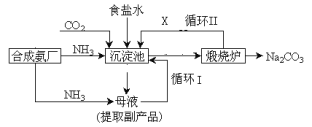
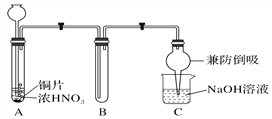
(1)写出通入CO2和NH3的化学反应方程式_________________________________________________。在 饱和食盐水中通入CO2和NH3,先通NH3后通CO2的原因是_____________________________。
(2)母液中除H+和OH-外,还含有的离子是_____________。 向母液中通氨气,加入细小食盐颗粒,冷却 析出副产品,通氨气的作用有____________。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(3)上述流程中X物质的分子式_______。使原料氯化钠的利用率从70%提高到90%以上,主要是 设计了_______(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____。
(4)写出检验产品碳酸钠中是否含有氯化钠的简要方案:___________________________________________________________________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
称取样品ag,加水溶解,加入足量的BaCl2溶液,经过滤、洗涤、干燥,最终得到固体bg。样品中纯 碱的质量分数为___________________(用含a、b的代数式表示)。
【答案】NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl 氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀。 Na+、HCO3-、NH4+、Cl- a、c CO2 I 过滤 可取少量试样溶于水后,再滴加足量的稀硝酸和少量的硝酸银溶液,若产生白色沉淀不溶解,说明有Cl- 106 b/197a
【解析】
联合制碱法:以食盐、氨和二氧化碳为原料来制取纯碱,二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,反应为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,经过滤、洗涤得NaHCO3微小晶体,再加热制得纯碱产品,其滤液是含有氯化铵和氯化钠的溶液,从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品。
(1)二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl;二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,且碳酸不稳定,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵;故答案为:NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl;氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀;
(2)由上述分析可知,母液中除H+和OH-外,还含有的离子是Na+、HCO3-、NH4+、Cl-;氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵析出来,故a正确;通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,所以选项c正确,选项b错误;故答案为:Na+、HCO3-、NH4+、Cl-; a、c;
(3)侯氏制碱法反应方程式为NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓,得到碳酸氢钠同时得到氯化铵,二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,故X是二氧化碳;因为氯化钠最后剩余在母液中,所以循环I是氯化钠的循环,使原料氯化钠的利用率提高;分离沉淀的方法是过滤;故答案为:CO2;I;过滤;
(4)要检验碳酸钠中含有氯化钠,需要先加硝酸将碳酸钠除去,然后加入硝酸银溶液,若有沉淀产生,说明碳酸钠中含有氯化钠,否则不含氯化钠;故答案为:可取少量试样溶于水后,再滴加足量的稀硝酸和少量的硝酸银溶液,若产生白色沉淀不溶解,说明有Cl-;
(5)加入足量的 BaCl2溶液:发生反应:Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3~BaCO3,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,恒重操作后最终得到固体 b(g)为BaCO3,根据碳守恒,纯碱的质量分数=![]() ;故答案为:
;故答案为: ![]() 。
。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。
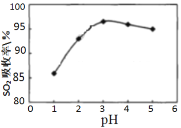
(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
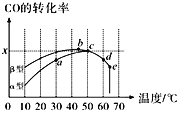
(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
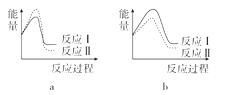
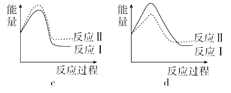
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
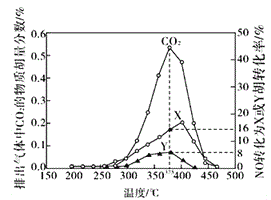
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。
【题目】
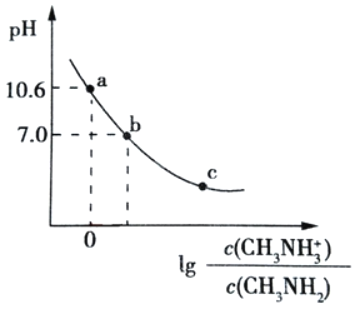
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。