题目内容
【题目】卤素及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
①氧化剂与还原剂的物质的量比是_______;如果反应生成0.3mol的单质碘,则转移的电子数目是_______。
②先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,这时候,观察到的现象是_____;
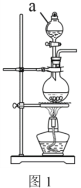
③若采用下图实验装置将四氯化碳和I2的混合溶液分离。
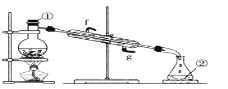
写出图中仪器的名称:①_____;该装置还缺少的仪器是_____;冷凝管的进水口是:_____(填g或f)。
(2)实验室常用MnO2和浓盐酸制氯气,反应原理:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①实验室用MnO2和浓盐酸制氯气的离子方程式:__________________________
②上述反应中氧化剂:__________,还原剂:__________,被氧化的HCl和未被氧化的HCl的比值______________。
③a : Cl2+2I-=I2+2Cl-; b: Cl2+2Fe2+=2Fe3++Cl-; c:2Fe3++2I-=I2+2Fe2+。 Cl2、I2、Fe3+的氧化性由强到弱的顺序:_________________________
【答案】1:5 0.5NA 溶液分层,下层液为紫红色 蒸馏烧瓶 温度计 g MnO2+4H++2Cl-(浓)![]() Mn2++Cl2↑+2H2O MnO2 HCl 1:1 Cl2>Fe3+>I2
Mn2++Cl2↑+2H2O MnO2 HCl 1:1 Cl2>Fe3+>I2
【解析】
(1)①KIO3+5KI+3H2SO4→3I2+3K2SO4+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,化合价升高值=化合价降低值=转移电子数,根据化合价变化确定电子转移情况;
②碘易溶于有机溶剂,在四氯化碳在的溶解度远大于在水中,加入四氯化碳萃取水中的碘,四氯化碳与水不互溶,溶液分成两层,四氯化碳的密度比水,有机层在下层,碘溶于四氯化碳呈紫红色,上层几乎无色;
③依据蒸馏的正确操作与注意事项分析;
(2)①实验室常用MnO2和浓盐酸制氯气;
②依据氧化还原反应的规律分析;
③依据氧化剂的氧化性大于氧化产物的氧化性分析作答;
(1)①反应中氧化剂为KIO3,还原剂为KI,氧化剂与还原剂的物质的量比是1:5;生成3molI2,电子转移5mol,生成0.3mol的单质碘转移的电子0.5mol,转移的电子的数目为0.5NA;
②溶液分层且I2溶于CCl4中呈紫色,密度较大,因此观察到的现象是溶液分层,下层液为紫红色;
③该图为蒸馏装置①是蒸馏烧瓶,②是锥形瓶;在蒸馏时需要测量温度,还需要温度计;冷凝水进出水方向为“下进上出”,即g口为进水口;
(2)①实验室常用MnO2和浓盐酸制氯气,反应原理:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子反应为:MnO2+4H++2Cl-(浓)
MnCl2+Cl2↑+2H2O,离子反应为:MnO2+4H++2Cl-(浓)![]() Mn2++ Cl2↑+2H2O;
Mn2++ Cl2↑+2H2O;
②反应中Mn元素化合价从+4价降低到+2价,Cl元素化合价从-1价升高到0价,MnO2作氧化剂,HCl作还原性,盐酸具有还原性和酸性,且被氧化的HCl和未被氧化的HCl的比值为1:1;
③a反应中Cl2作氧化剂,I2为氧化产物,氧化性Cl2> I2,b反应中Cl2作氧化剂,Fe3+为氧化产物,氧化性Cl2> Fe3+,c反应中Fe3+作氧化剂,I2为氧化产物,氧化性Fe3+> I2,综上,氧化性Cl2>Fe3+>I2。

 寒假学与练系列答案
寒假学与练系列答案