题目内容
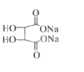
【题目】常温下,向20.00mL0.1mol/L的甲胺(CH3NH2)溶液中滴加0.1mol/L 的盐酸,混合溶液的pH与相关微粒浓度比值的对数关系如图所示。下列说法不正确的是( )
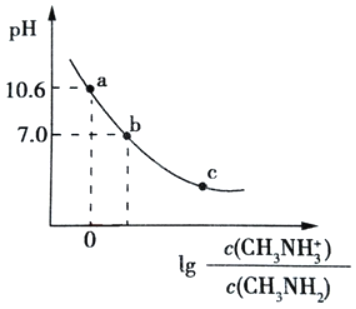
A.已知甲胺的碱性稍强于氨,甲胺在水中的电离方程式为CH3NH3++H2OCH3NH2+OH﹣
B.b点加入的盐酸体积V<20.00 mL
C.将等物质的量的CH3NH2和CH3NH3Cl 溶于蒸馏水,可得到 a 点对应的溶液
D.常温下,甲胺的电离常数为 Kb,则 pKb=-lgKb=3.4
【答案】C
【解析】
A.甲胺(CH3NH2)类似于氨,但碱性稍强于氨,说明甲胺也是弱电解质,在水溶液中部分电离,其电离方程式为CH3NH2+H2OCH3NH3++OH﹣,故A正确;
B.CH3NH3Cl为强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则甲胺应该稍微过量,甲胺和稀盐酸浓度相等,所以甲胺体积大于盐酸,则加入稀盐酸体积小于20mL,故B正确;
C.将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,CH3NH2电离程度大于CH3NH3Cl水解程度,所以溶液中c(CH3NH3+)>c(CH3NH2),lg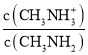 >0,应该在a、b之间,故C错误;
>0,应该在a、b之间,故C错误;
D.当lg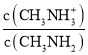 =0时,c(CH3NH2)=c(CH3NH3+),溶液的pH=10.6,则Kb=
=0时,c(CH3NH2)=c(CH3NH3+),溶液的pH=10.6,则Kb=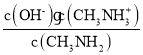 =c(OH﹣)=
=c(OH﹣)=![]() =10﹣3.4,所以pKb=﹣lgKb=3.4,故D正确;
=10﹣3.4,所以pKb=﹣lgKb=3.4,故D正确;
答案选C。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目