题目内容
【题目】某些资料表明:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析Na2O2和NO2都有氧化性,根据化合价升降原则提出如下假设:
假设Ⅰ. Na2O2氧化NO2; 假设Ⅱ. NO2氧化Na2O2。
请回答下列问题:
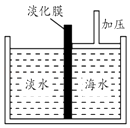
(1)甲同学设计如图1所示实验装置:
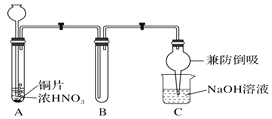
图1
①试管A中反应的离子方程式是___________________________________________________。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。甲同学据此认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个装置,该装置的作用是__________________________________________________________________。
③乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是_____________________。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化,查阅资料知:
ⅰ) 2NO+Na2O2===2NaNO2;
ⅱ) 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O;
ⅲ)酸性条件下,NO或NO![]() 都能与MnO
都能与MnO![]() 反应生成NO
反应生成NO![]() 和Mn2+。
和Mn2+。
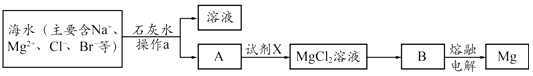
丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应:
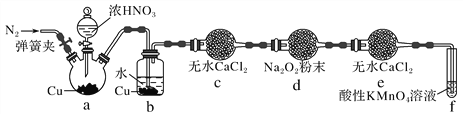
图2
①b装置中观察到的主要现象是__________________________________________________,f装置的作用是_________________________________________________________________。
②在反应前,先打开弹簧夹,通入一段时间N2,其目的是____________________________
③充分反应后,检验d装置中发生反应的实验是___________________________。
【答案】 Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O 除去生成的NO2中混有的水蒸气 Na2O2+2NO2===2NaNO3 铜片逐渐溶解,溶液变为蓝色,有气泡产生 吸收未反应的NO 将装置中的空气排出 取d装置中产物少许,加入稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物是NaNO2,反之为NaNO3
===Cu2++2NO2↑+2H2O 除去生成的NO2中混有的水蒸气 Na2O2+2NO2===2NaNO3 铜片逐渐溶解,溶液变为蓝色,有气泡产生 吸收未反应的NO 将装置中的空气排出 取d装置中产物少许,加入稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物是NaNO2,反之为NaNO3
【解析】(1)①试管A中利用铜和浓硫酸反应制备二氧化氮,该反应的离子方程式是Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O。
===Cu2++2NO2↑+2H2O。
②待试管B中收集满气体,向试管B中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,说明有氧气生成。由于A中制备的二氧化氮含有一定量的水蒸气,而水蒸气可以和过氧化钠反应生成氧气,故乙同学认为该装置不能达到实验目的,为达到实验目的,应在A、B之间增加一个可以除去NO2中混有的水蒸气的装置,以排除实验干扰。
③乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的化学方程式是Na2O2+2NO2===2NaNO3。
(2)由图中信息可知,a装置制备二氧化氮气体,b装置用于制备NO气体,c装置用于干燥NO,d装置用于NO与过氧化钠混合,e装置用于防止f装置的水蒸气进入d装置干扰实验,f装置用于尾气处理,防止剩余的NO污染空气。
①b装置中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有气泡产生,f装置的作用是吸收未反应的NO。
②在反应前,先打开弹簧夹,通入一段时间N2,其目的是将装置中的空气排出,防止空气中的氧气干扰实验。
③充分反应后,检验d装置中发生反应后的产物究竟是NaNO2还是NaNO3。由题中信息可知, 6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O,NO遇到空气中的氧气可以被氧化为红棕色的NO2,而NaNO3不与稀硫酸反应,故实验方法是:取d装置中产物少许,加入稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物是NaNO2,反之为NaNO3。

【题目】下表列出了①~⑩十种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
请按要求回答下列问题。
(1)元素⑧对应的简单离子的结构示意图是____________。
(2)以上元素中,化学性质最不活泼的是 ____________(填元素符号)。
(3)写出元素⑤形成的单质在空气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”或“放热”)反应。
(4)用电子式表示④与⑤形成的A2B型化合物的形成过程___________________________。
(5)在这些元素的最高价氧化物对应水化物中,酸性最强的化合物的分子式是:__________,与元素⑥的最高价氧化物对应水化物发生反应时的离子方程式为________________
(6)③的简单氢化物与③的最高价氧化物对应的水化物反应的生成物中含有的的化学键有____________________________。