题目内容
【题目】高铁酸盐是新型、高效、多功能的绿色水处理剂。
(1)配平化学方程式并标出电子转移方向和数目:
_____Fe(OH)3+ NaClO+ NaOH→ Na2FeO4+ NaCl+ H2O
反应中氧化剂是_____,被还原的元素是_____;
(2)若上述反应中转移0.3mol电子,则消耗NaOH的物质的量为_____;
(3)高铁酸钠和二氧化氯都是高效杀菌消毒剂,消毒效率(单位物质的量转移的电子数)高铁酸钠是二氧化氯的_____倍;
(4)含Fe3+的溶液与NaHCO3混合,产生红褐色沉淀,同时有无色无味的气体生成,用平衡移动原理解释上述现象_____;
(5)比较同温下浓度均为0.01mol/L的①H2CO3、②Na2CO3、③NaHCO3、④NH4HCO3四种溶液中c(CO32﹣)的大小关系为_____(用编号表示)。
【答案】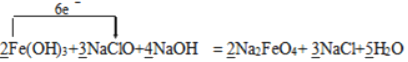 NaClO +1价的Cl 0.2mol 0.6 HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动 ②>③>④>①
NaClO +1价的Cl 0.2mol 0.6 HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动 ②>③>④>①
【解析】
根据反应可知铁元素的化合价从+3价升高到+6价,失去3个电子,氯元素的化合价从+1价降低到—1价,得到2个电子,则根据得失电子守恒可知氧化剂与还原剂的物质的量之比是3:2,再根据质量守恒定律可知反应的化学方程式可表示为2Fe(OH)3+ 3NaClO + 4NaOH=2 Na2FeO4 + 3 NaCl + 5H2O,据此回答。
⑴ 根据得失电子守恒和质量守恒定律可知反应的化学方程式可表示为2Fe(OH)3+ 3NaClO + 4NaOH=2 Na2FeO4 + 3 NaCl + 5H2O,氯元素的化合价降低,氯元素被还原,NaClO做氧化剂,故答案为: 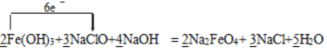 ;NaClO;+1价的Cl;
;NaClO;+1价的Cl;
⑵ 由分析可知,当转移6 mol电子时消耗4 mol NaOH,所以转移0.3mol电子时,消耗氢氧化钠物质的量为0.2mol,故答案为:0.2mol;
⑶ 化合价变化:Na2FeO4中Fe:+6 降到+3 ,变化为3,ClO2中 Cl:+4降到-1,变化为5,单位物质的量转移电子数之比为3:5=0.6倍,答案为:0.6;
⑷ 含Fe3+的溶液中存在Fe3+的水解平衡:Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+,加入NaHCO3,其中HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动,形成Fe(OH)3沉淀,故答案为:HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动;
Fe(OH)3 + 3H+,加入NaHCO3,其中HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动,形成Fe(OH)3沉淀,故答案为:HCO3-和Fe3+水解产生的H+发生反应生成CO2,促进Fe3+的水解平衡向右移动;
⑸要看其它离子对碳酸根离子的影响,②中存在大量CO32-,没有离子对碳酸根离子产生影响;③④对比,铵根离子水解促进HCO3-离子的水解,HCO3-的电离相对就弱了,所以③>④;碳酸的第二步电离才产生碳酸根离子,而碳酸的第二步电离很弱,CO32-极少,所以c(CO32﹣)的大小关系为②>③>④>①,故答案为:②>③>④>①。

 阅读快车系列答案
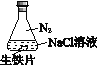
阅读快车系列答案【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2