题目内容
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。甲同学取钠、镁、铝各1mol分别投入到足量的盐酸中,预测实验结果。
(1)甲同学设计实验的目的是__。
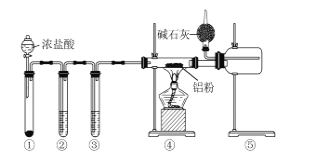
(2)利用如图所示装置可以验证非金属性的变化规律。
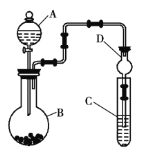
①仪器A的名称为__,干燥管D的作用是__。
②实验室中现有药品:Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为__、__、__,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为__。
③若要证明非金属性:S>C>Si,则A中加__,B中加Na2CO3,C中加__,观察到C中的现象为___。
【答案】验证钠、镁、铝的活泼性(或验证同一周期,从左到右元素的金属性强弱) 分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S溶液 S2-+Cl2=S↓+2Cl- 稀硫酸 Na2SiO3溶液 有白色沉淀产生
【解析】
根据实验方案分析设计实验的目的;根据金属活动性顺序表可以判断钠、镁、铝的活泼性,根据仪器的构造写出仪器A的名称并分析球形干燥管的作用;可以通过以强制弱的反应原理来设计实验验证非金属性,把握比较的条件。
(1)同一周期,从左到右元素的金属性逐渐减弱,所以甲同学设计实验的目的是验证钠镁铝活泼性,故答案为:验证钠、镁、铝的活泼性(或验证同一周期,从左到右元素的金属性强弱);
(2)①仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,故答案为:分液漏斗;防止倒吸;
②设计实验验证非金属性:Cl>S,利用氯气与Na2S的氧化还原反应可验证,由题中所给药品可知,可用Na2S与氯气发生置换反应来判断Cl与S非金属性的强弱,因为无加热装置,所以只能选择KMnO4与浓盐酸反应制取氯气,则装置A、B、C中所装药品应分别为浓盐酸、KMnO4、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为S2-+Cl2═S↓+2Cl-,故答案为:浓盐酸;KMnO4;Na2S溶液;S2-+Cl2═S↓+2Cl-;
③若要证明非金属性:C>Si,可以通过二氧化碳和硅酸钠反应生成难溶性的硅酸来证明,由于B中加Na2CO3,故A中可以加硫酸,通过硫酸和碳酸钠的反应来制取CO2,然后的CO2通入C中的Na2SiO3中,可以发生反应:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3,产生白色胶状沉淀,从而可以证明酸性:H2CO3>H2SiO3,故非金属性:C>Si,故答案为:稀硫酸;Na2SiO3溶液;有白色沉淀产生。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
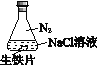
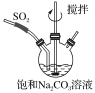
小学生10分钟应用题系列答案【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2