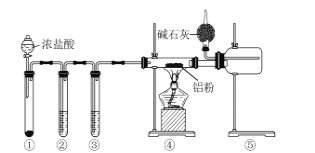
题目内容
【题目】下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是( )
A.纯碱B.氨气C.烧碱D.盐酸
【答案】A
【解析】
A. 工业生产纯碱的化学方程式为:NaCl + NH3 + H2O + CO2 = NaHCO3↓+ NH4Cl、2NaHCO3 ![]() Na2CO3 + CO2↑ + H2O↑ 都为复分解反应,不涉及氧化还原反应,故A正确;
Na2CO3 + CO2↑ + H2O↑ 都为复分解反应,不涉及氧化还原反应,故A正确;
B. 工业制氨气的化学方程式为:N2+3H2 ![]() 2NH3,有化合价变化,是氧化还原反应,故B错误;
2NH3,有化合价变化,是氧化还原反应,故B错误;
C. 工业制取烧碱的化学方程式为:2NaCl + 2H2O ![]() 2NaOH + H2↑ + Cl2↑,有化合价变化,是氧化还原反应,故C错误;
2NaOH + H2↑ + Cl2↑,有化合价变化,是氧化还原反应,故C错误;
D. 工业制取盐酸:H2 + Cl2 ![]() 2HCl,HCl溶于水形成盐酸,有化合价变化,是氧化还原反应,故D错误;
2HCl,HCl溶于水形成盐酸,有化合价变化,是氧化还原反应,故D错误;
故答案为A。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目