题目内容
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
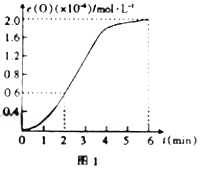
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
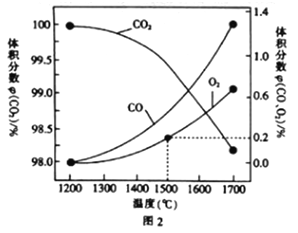
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
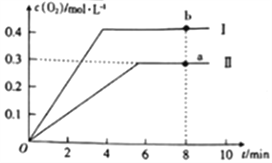
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
【答案】 0.84g -33.5 < 3×10-7mol/(L·min) AC 3.2×10-8mol/L 升温 <
【解析】(1) CO2与过氧化钠反应生成碳酸钠和氧气,根据反应规律分析可知固体质量增加量相当于增加CO的量;CO2与过氧化钠反应生成氧气,氧气再与0.01molCO电火花点燃生成0.01 molCO2,也就是相当于0.03 molCO2与过氧化钠反应,固体增加的量为0.03molCO的量,质量为0.03×28=0.84g;正确答案:0.84g。
(2)已知:2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,O2(g)==2O(g) △H=499.0kJ/mol;根据盖斯定律可知,两个方程相加除以2即可得到CO(g)+O2(g)![]() CO2(g)+O(g)△H=-33.5 kJ/mol;正确答案:-33.5。
CO2(g)+O(g)△H=-33.5 kJ/mol;正确答案:-33.5。
②某时刻该反应体系中各物质浓度满足c(CO)·c(O2)=c(CO2) ·c(O),则QC= c(CO2) ×c(O)/ c(CO)×c(O2)=1>0.4, 则反应向左进行, 则此时v(正) <v(逆);正确答案:<。
③2min内O的浓度增大0.6×10-6mol/L,则二氧化碳减小0.6×10-6mol/L,则v(CO2)= 0.6×10-6/2=3×10-7 mol/(L·min);正确答案: 3×10-7 mol/(L·min)。
(3) ①CO的体积分数保持不变说明正逆反应速率相等,达到平衡状态,A正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内混合气体的密度保持不变不能说明反应达到平衡状态,B错误;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以容器内混合气体的平均摩尔质量保持不变说明反应达到平衡状态,C正确;D.单位时间内消耗CO的浓度始终等于生成CO2的浓度,反应速率同向,不能判定反应达到平衡状态,D错误;正确答案AC。
②设生成的氧气为xmol,![]()
![]()
起始量![]() 00
00
转化量![]()
![]() x
x
平衡量![]() 2xx,
2xx,
平衡时,氧气的体积分数为0.2,则![]() ,则
,则![]() ,则
,则![]() ,
,![]() ,
,![]() ,
,
则![]() ;正确答案:
;正确答案:![]() 。
。
③若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且氧气的浓度增大,平衡正向进行,改变条件是升温;a、b两点后,a点温度小于b点,所以用CO浓度变化表示的反应速率关系为va(CO) <vb(CO);正确答案:升温;<。