题目内容
【题目】在固态金属氧化物燃料电解池中,以H2—CO混合气体为燃料,基本原理如右图所示。下列说法不正确的是
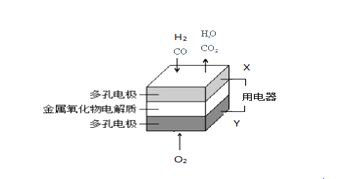
A. Y极是原电池的正极,发生还原反应
B. 负极的电极反应式是:H2-2eˉ+O2ˉ=H2O CO-2eˉ+O2ˉ= CO2
C. 总反应可表示为:H2+CO+O2 = H2O+CO2
D. 同温同压下两极消耗的气体的体积之比是1︰1
【答案】D
【解析】根据图示知:与X相连的电极通入H2、CO,所以X是负极,Y是正极,负极上发生氧化反应,电极反应式为:H2+O2--2e-=H2O、CO+O2--2e-=CO2,正极上发生还原反应,电极反应式为:O2+4e-=O2-,总反应为:H2+CO+O2=H2O+CO2。A.根据图示知:与X相连的电极通入H2、CO,所以X是负极,Y是正极,故A正确;B.负极上发生氧化反应,电极反应式为:H2+O2--2e-=H2O、CO+O2--2e-=CO2,故B正确;C、根据正负极的电极反应式可知,总反应式可以为:H2+CO+O2=H2O+CO2,故C正确;D、总反应式可表示为:H2+CO+O2=H2O+CO2,同温同压下两极消耗的气体体积之比是2:1,故D错误;故选D。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D