题目内容
【题目】科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A. 该原子的摩尔质量是a NA B. W g该原子的物质的量是:W/(aNA)mol
C. W g该原子中含有W/a个该原子 D. 由已知信息可得: ![]()
【答案】A
【解析】
A.摩尔质量是单位物质的量的物质所具有的质量,单位是gmol-1,一个原子的质量是a g,则1mol的质量即NA个原子的质量之和为aNA,所以摩尔质量应为aNA g/mol,故A可选;
B.该原子的摩尔质量为a NA g/mol,Wg该原子的物质的量为W/(aNA)mol,故B不选;
C.根据题意可以知道,该原子的质量为ag,故Wg该原子的数目为W/a,故C不选;
D. 12C的原子的摩尔质量为12g/mol,一个12C的原子的质量为bg,故bNA=12,所以NA=12/b,故D不选;
综上所述,本题选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
(1)用催化技术将汽车尾气中的NO和CO转变成CO2和N2,反应原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
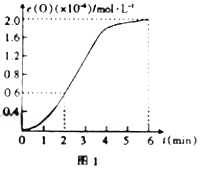
某温度下测得该反应在不同时间的CO浓度如下表:
时间(s) 浓度 ×10-3(molL-1) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
该反应平衡常数K的表达式____________________;温度升高,K值___________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=_______________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_________。
(2)工业合成氨的反应温度选择500℃左右的主要原因是______________________。
(3)在固定容积的密闭容器中,加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是__________________________________________________。
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液呈现酸性的原因________________________________(用离子方程式表示);在通入NH3的过程中溶液的导电能力______(选填“变大”、“变小”、“几乎不变”)。