��Ŀ����
����Ŀ�������������ǵ����ϼ�Ϊ�ḻ��Ԫ�ء���ش���������:
(1)X+�����е���ǡ�ó���K��L��M3�����Ӳ㡣
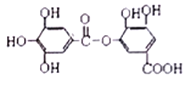
��X+��N3-�γɵľ���ṹ��ͼ��ʾ��Xԭ�ӵ�ԭ��������____����̬N3-�ĵ����Ų�ʽΪ______����N3-�Ⱦ����������X+��______����

��X2+��Zn2+�ֱ����NH3�γ�[X(NH3)4]2+��[Zn(NH3)4]2+���������������ṩ�µ��ӶԵ�ԭ�Ӿ�Ϊ_______(дԪ������)����֪���������Ӷ����жԳƵĿռ乹�ͣ�[Zn(NH3)4]2+�е�����NH3������Cl-ȡ��ֻ�ܵõ�һ�ֽṹ�IJ����[X(NH3)4]2+�е�����NH3������Cl-ȡ���ܵõ����ֽṹ��ͬ�IJ����[X(NH3)4]2+�Ŀռ乹��Ϊ_______��[Zn(NH3)4]2+��Zn���ӻ�����Ϊ_______________��
��2����������������ˮ���������ԣ����ݶԽ��߹���д��BeO��NaOH��Һ��Ӧ�����ӷ���ʽ_____________________________���ε���Ҳ�����ԣ�д���ε��������ᷴӦ�Ļ�ѧ����ʽ_______________��
���𰸡� 29 1s22s22p6 6 �� ƽ�������� sp3 BeO + 2OH- = BeO22- + H2O HIO + HCl = ICl + H2O
�������� (1)X+�����е���ǡ�ó���K��L��M3�����Ӳ�����X+�ĵ����Ų�ʽΪ[Ar]3d10����XΪCuԪ����
��Xԭ�ӵ�ԭ��������29����X+��N3-�γ�Cu3N�ľ���ṹʾ��ͼ��֪���þ���ľ�����X+��N3-����Ŀ�ֱ���3��1��N3-�ھ����Ķ�������̬N3-�ĵ����Ų�ʽΪ1s22s22p6����N3-�Ⱦ����������X+��6����
��X2+��Zn2+�ֱ����NH3�γ�[X(NH3)4]2+��[Zn(NH3)4]2+���������������ṩ�µ��ӶԵ�ԭ�Ӿ�Ϊ������֪���������Ӷ����жԳƵĿռ乹�ͣ�[Zn(NH3)4]2+�е�����NH3������Cl-ȡ��ֻ�ܵõ�һ�ֽṹ�IJ��˵������������������ṹ����[Zn(NH3)4]2+��Zn���ӻ�����Ϊsp3��[X(NH3)4]2+�е�����NH3������Cl-ȡ���ܵõ����ֽṹ��ͬ�IJ����[X(NH3)4]2+�Ŀռ乹��Ϊƽ����������
��2����������������ˮ���������ԣ����ݶԽ��߹�����BeO���������������NaOH��Һ��Ӧ�����ӷ���ʽΪBeO + 2OH- = BeO22- + H2O���ε���Ҳ�����ԣ��ε��������ᷴӦ�Ļ�ѧ����ʽΪHIO + HCl = ICl + H2O��

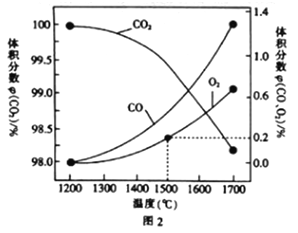
����Ŀ�����ĵ��ʼ��仯�������ʶ�������;�㷺�����������գ�
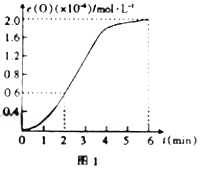
��1���ô�����������β���е�NO��COת���CO2��N2����Ӧԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
ij�¶��²�ø÷�Ӧ�ڲ�ͬʱ���COŨ�����±���
ʱ�䣨s�� Ũ�� ��10-3��molL-1�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��CO�� | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
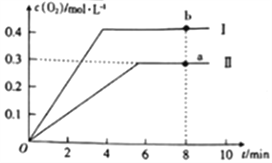
�÷�Ӧƽ�ⳣ��K�ı���ʽ____________________���¶����ߣ�Kֵ___________��ѡ����������������С����������������ǰ2s�ڵ�ƽ����Ӧ����v(N2)=_______________����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ��_________��
��2����ҵ�ϳɰ��ķ�Ӧ�¶�ѡ��500�����ҵ���Ҫԭ����______________________��
��3���ڹ̶��ݻ����ܱ������У�����1mol������3mol����ģ�ҵ�ϳɰ�����Ӧ��һ���������Ѵﵽƽ��ı�־��__________________________________________________��
��4����������1mol���ʵ�ϡ�����л���ͨ��1molNH3����Һ����仯���Բ��ƣ�����Ӧ��������Һ�������Ե�ԭ��________________________________�������ӷ���ʽ��ʾ������ͨ��NH3�Ĺ�������Һ�ĵ�������______��ѡ���������������С��������������������