氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N
2(g) + 3H
2(g)
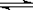
2NH
3(g);Δ
H =" -92.2" kJ·mol
-1。
① 一定温度下,在容积恒定的密闭容器中,一定量的N
2和H
2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t
4 ﹑t
5﹑t
7时刻所对应的实验条件改变分别是
t
4 t
5 t
7 。

②温度为T℃时,将2amolH
2和amolN
2放入0.5L密闭容器中,充分反应后测得N
2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为
。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H
2O(g)
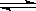
H
2(g) + CO(g) △
H =" +131.3" kJ/mol
①该反应在低温下不能自发进行的原因是
。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g)
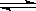
H
2(g)+I
2(g) 达到平衡后,平衡时I
2的浓度c(I
2)
A c(I
2)
B ;平衡时HI的分解率α
A α
B ;平衡时H
2在混合气体中的体积分数A
B (填写“>”“<”“=”)

