题目内容
已知2SO2+O2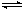 2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是
2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是
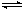 2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是
2SO3;△H=-92.6 kJ·mol-1,当反应达到平衡时,下列措施:①降低温度;②减小压强;③用V2O5作催化剂;④增大O2的浓度;⑤增大SO2的浓度;⑥恒压通入He气,能提高SO2转化率的是| A.①②⑥ | B.①④⑤ | C.④⑤⑥ | D.①④ |
D
略

练习册系列答案
相关题目
 [Cu(NH3)4]2++2OH-+4H2O,有下列实验操作:
[Cu(NH3)4]2++2OH-+4H2O,有下列实验操作: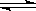 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定
2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定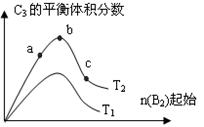
 00℃时充分反应,达平衡后C3的浓度为
00℃时充分反应,达平衡后C3的浓度为 衡后,吸收热量Q3
衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。
kJ,C3浓度 (填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系 (用代数式表示)。 器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。
器(反应前体积相同),起始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 ( 填 > 、 = 、 < ),理由是 。 PCl3(g)+Cl2(g) △H>0 K=1 ①
PCl3(g)+Cl2(g) △H>0 K=1 ① 2 C(g)
2 C(g) 2C(g)+D(g) 已达平衡状态的是 ( )
2C(g)+D(g) 已达平衡状态的是 ( )  2C(正反应放热),A的最大转化率与温度曲线如右图,下列叙述正确的是
2C(正反应放热),A的最大转化率与温度曲线如右图,下列叙述正确的是 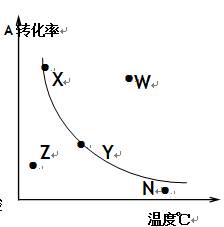
 2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为下列的 ( )
2SO3(g)并达到平衡,在此过程中,甲维持容器的体积不变,乙维持容器的压强不变,若甲中SO2的转化率为a%,则对乙中SO2的转化率的合理描述为下列的 ( )