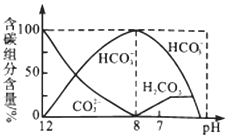
题目内容
【题目】某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是

A.溶液中A2+浓度减小
B.B 的电极反应: B-2eˉ=B2+
C.y 电极上有 H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
【答案】D
【解析】
图B中的两电极均为石墨,即B装置为电解装置,A装置为原电池装置。当 K 闭合时,在交换膜处 SO42一从右向左移动,即可知A电极为原电池的负极,B为原电池的正极,所以y电极为电解池装置的阳极,x电极为电解池装置的阴极。
A、A处的电极反应式为:A-2e-=A2+;溶液中A2+增大,A错误;
B、B电极是正极得电子的一极,B错误;
C、在y中,电极反应式为:2Cl-—2e-=Cl2↑,C错误;
D、在x极,电极反应式为:2H++2e-=H2↑,破坏了附近的水的电离平衡,在x周围,c(OH-)增大,生成氢氧化铝沉淀,随c(OH-)溶液的增大,氢氧化铝逐渐溶解,D正确;
答案选D。

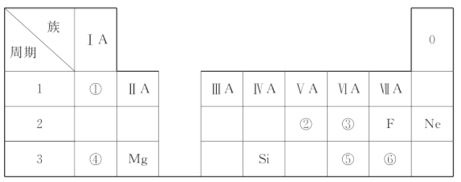
【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”、“生物金属”,其基态原子最高能级有3个空轨道 |
W | 原子M能层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______。
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”)。
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示)。
(4)Na在Y2中燃烧产物的电子式为________________。
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体。
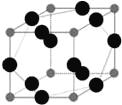
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3。
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()