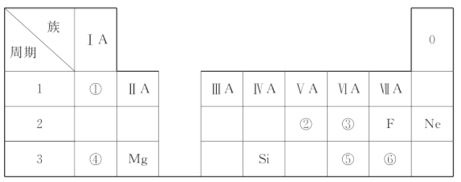
题目内容
【题目】下列各组离子能在指定的环境下可以大量共存的是( )
A.在pH=0的溶液中:Na+、Fe2+、Cl-、![]()
B.由水电离出的c(H+)=1×10-14mol/L的溶液:K+、![]() 、Cl-、
、Cl-、![]()
C.c(H+)<c(OH-)溶液:Na+、K+、![]() 、
、![]()
D.PH=2的一元酸和PH=12的一元强碱等体积混合:c(OH-)=C(H+)
【答案】C
【解析】
根据题中各组离子可以大量共存可知,本题考查离子共存,运用离子共存条件分析。
A. pH=0的溶液先酸性,酸性溶液中![]() 和H+ 把Fe2+氧化成Fe3+,A项错误;
和H+ 把Fe2+氧化成Fe3+,A项错误;
B. 由水电离出的c(H+)=1×10-14mol/L的溶液,溶液可能显酸性可能显碱性,显酸性时CO32-不能共存,显碱性时![]() 不能共存。B项错误;
不能共存。B项错误;
C. c(H+)<c(OH-)溶液显碱性,溶液中各离子不反应,可以共存,C项正确;
D. pH=2的一元酸和pH=12的一元强碱等体积混合,谁弱呈谁性,酸性、中性、碱性都有可能, D项错误;
答案选C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】已知X、Y、Z三种元素均为短周期元素,原子序数依次递增,Q、W为前30号元素。5种元素的部分特点:
元素 | 特点 |
X | 其气态氢化物呈三角锥形,水溶液显碱性 |
Y | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
Z | 元素原子的外围电子层排布式为nsn-1npn-1 |
Q | 被誉为“太空金属”、“生物金属”,其基态原子最高能级有3个空轨道 |
W | 原子M能层为全充满状态且核外的未成对电子只有一个 |
(1)XF3分子中X的杂化类型为______,该分子的空间构型为_______。
(2)基态Q原子的电子排布式为_____________________,第一电离能:X______Y(填“>” “<”或“=”)。
(3)X、Y、Z电负性由大到小的顺序为____________(用元素符号表示)。
(4)Na在Y2中燃烧产物的电子式为________________。
(5)Z和X形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于_______晶体。
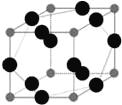
(6)W元素与X元素形成某种化合物的晶胞结构如图所示(黑球代表W原子),若该晶体的密度为ρ g·cm-3,则该晶胞的体积是__________cm3。