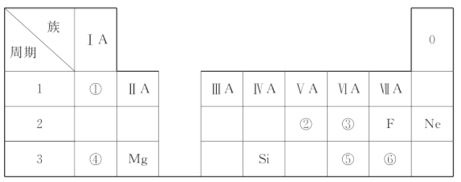
题目内容
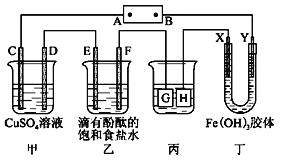
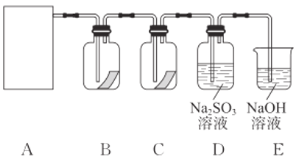
【题目】“84消毒液”是生活中常用的消毒剂,可与硫酸反应制取氯气,反应原理为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学利用此原理制氯气并设计了如图所示的实验装置。
(1)上述制备氯气的反应中,每生成1molCl2,转移的电子的物质的量是________mol。
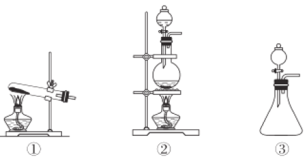
(2)依据上述反应原理,从下列装置中选择合适的制氯气装置(A处)________(填序号)。
(3)装置B、C中依次盛放的是干燥的红色布条和湿润的红色布条,其目的是________。实验过程中该同学发现装置B中的布条也褪色,说明该装置存在明显的缺陷,改进的方法是________。
(4)E中NaOH溶液吸收氯气时发生反应的化学方程式是________。
(5)D中氯气可将![]() 氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
氧化,若通过实验验证该反应发生的是氧化还原反应,可采取的方法是________(写出操作、试剂和现象)。
【答案】1 ② 验证干燥的氯气不具有漂白性 在装置A、B之间增加盛有浓硫酸的洗气瓶 Cl2+2NaOH=NaCl+NaClO+H2O 取少量反应后溶液于试管中,先加入足量的稀盐酸至无明显现象,然后再加入少量BaCl2溶液,有白色沉淀生成
【解析】
(1) 根据NaClO+NaCl+H2SO4 ![]() Na2SO4+Cl2↑+H2O反应中元素化合价的变化和氧化还原反应的规律计算;
Na2SO4+Cl2↑+H2O反应中元素化合价的变化和氧化还原反应的规律计算;
(2)根据反应物的状态和反应条件选择合适的气体发生装置;
(3) 根据氯气没有漂白性,次氯酸具有漂白性分析解答;
(4)氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,据此书写反应的化学方程式;
(5) 氯气把 SO![]() 氧化为SO
氧化为SO![]() ,可以通过检验反应后的溶液中是否存在硫酸根离子来验证该反应发生的是否为氧化还原反应。
,可以通过检验反应后的溶液中是否存在硫酸根离子来验证该反应发生的是否为氧化还原反应。
(1) NaClO+NaCl+H2SO4 ![]() Na2SO4+Cl2↑+H2O反应中只有Cl元素的化合价发生变化,由+1价和-1价变成0价,转移1个电子,则生成1molCl2,转移电子1mol,故答案为:1;
Na2SO4+Cl2↑+H2O反应中只有Cl元素的化合价发生变化,由+1价和-1价变成0价,转移1个电子,则生成1molCl2,转移电子1mol,故答案为:1;
(2)由NaClO+NaCl+H2SO4 ![]() Na2SO4+Cl2↑+H2O可知,反应有液体参与,需要加热,所以选择装置②作为气体发生装置,故答案为:②;
Na2SO4+Cl2↑+H2O可知,反应有液体参与,需要加热,所以选择装置②作为气体发生装置,故答案为:②;
(3) 氯气没有漂白性,次氯酸具有漂白性,装置B、C中依次盛放的是干燥的红色布条和湿润的红色布条,目的是验证干燥的氯气不具有漂白性;装置B中干燥的有色布条褪色,说明氯气中可能混有少量的水蒸气,氯气与水反应生成次氯酸而漂白,因此应在A和B之间增加盛有浓硫酸的洗气瓶,除去氯气中的水蒸气,故答案为:验证干燥的氯气不具有漂白性;在装置A、B之间增加盛有浓硫酸的洗气瓶;
(4)尾气中的氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)氯气把 SO![]() 氧化为SO
氧化为SO![]() ,自身被还原为Cl-,反应离子方程式为SO
,自身被还原为Cl-,反应离子方程式为SO![]() +Cl2+H2O=SO
+Cl2+H2O=SO![]() +2Cl-+2H+;通过检验反应后的溶液中存在硫酸根离子即可验证该反应发生的是氧化还原反应,检验反应后溶液中含有SO
+2Cl-+2H+;通过检验反应后的溶液中存在硫酸根离子即可验证该反应发生的是氧化还原反应,检验反应后溶液中含有SO![]() 的方法为:取少量反应后溶液于试管中,先加入足量的稀盐酸至无明显现象,然后再加入少量BaCl2溶液,有白色沉淀生成,说明含有SO
的方法为:取少量反应后溶液于试管中,先加入足量的稀盐酸至无明显现象,然后再加入少量BaCl2溶液,有白色沉淀生成,说明含有SO![]() ,说明该反应发生的是氧化还原反应,故答案为:取少量反应后溶液于试管中,先加入足量的稀盐酸至无明显现象,然后再加入少量BaCl2溶液,有白色沉淀生成。
,说明该反应发生的是氧化还原反应,故答案为:取少量反应后溶液于试管中,先加入足量的稀盐酸至无明显现象,然后再加入少量BaCl2溶液,有白色沉淀生成。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案