题目内容
【题目】[物质结构与性质]
继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料![]() 并获得了该化合物的LED器件。
并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有______个延展方向;C原子的基态电子排布式为______;
(2)![]() 与
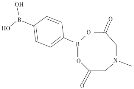
与![]() 互为等电子体,构型为_______;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
互为等电子体,构型为_______;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为__________、__________。
(3)石墨的熔点大于金刚石的熔点,试分析原因:________。
(4)![]() 可用
可用![]() 检验,其对应的酸有两种,分别为硫氰酸(HSC≡N)和异硫氰酸(HN=C=S),这两种酸中沸点较高的是____________,试分析原因:_________;热稳定性:
检验,其对应的酸有两种,分别为硫氰酸(HSC≡N)和异硫氰酸(HN=C=S),这两种酸中沸点较高的是____________,试分析原因:_________;热稳定性:![]() _______(填“<”“>”或“=”)
_______(填“<”“>”或“=”)![]() 。
。
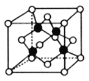
(5)超高热导率半导体材料——砷化硼(BAs)晶胞结构如图所示(As位于体内,B位于顶点和面心),已知晶胞参数为a pm,阿伏加德罗常数的值为![]() ,As原子到B原子最近距离为________(用含a的式子表示),该晶体的密度是_______g.cm-3 (列出含a、
,As原子到B原子最近距离为________(用含a的式子表示),该晶体的密度是_______g.cm-3 (列出含a、![]() 的计算式即可)。
的计算式即可)。
【答案】3 ![]() 平面正三角形
平面正三角形 ![]()
![]() 石墨层内碳碳键的键长比金刚石碳碳键的键长短,故石墨键能大,熔化时破坏的作用力强,熔点高 异硫氰酸(HN=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 <
石墨层内碳碳键的键长比金刚石碳碳键的键长短,故石墨键能大,熔化时破坏的作用力强,熔点高 异硫氰酸(HN=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 < ![]()
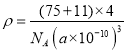
【解析】
(1)基态O原子能量最高的电子所在能级是2p,电子云在空间有3个延展方向;碳原子的基态电子排布式为![]() 。
。
(2)![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 中心原子有3对价层电子对,构型为平面正三角形;根据苯-1,4-二硼酸甲基亚氨基二乙酸酯结构可知,B原子周围价层电子对为3对,杂化方式为sp2,N原子周围孤电子对为1对,成键电子对为3对,价层电子对为4对,杂化方式为sp3。
中心原子有3对价层电子对,构型为平面正三角形;根据苯-1,4-二硼酸甲基亚氨基二乙酸酯结构可知,B原子周围价层电子对为3对,杂化方式为sp2,N原子周围孤电子对为1对,成键电子对为3对,价层电子对为4对,杂化方式为sp3。
(3)石墨层内碳原子采用的是sp2杂化,石墨层内碳碳键的键长比金刚石碳碳键的键长短,故石墨键能大,熔化时的破坏作用力强,石墨熔点更高;
(4)异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键;![]() 分解温度低于
分解温度低于![]() ;原因是MgO比BaO晶格能大易形成稳定的氧化物,所以
;原因是MgO比BaO晶格能大易形成稳定的氧化物,所以![]() 更易分解,热稳定性差。
更易分解,热稳定性差。
(5)观察结构,As原子到B原子最近距离正好是整个晶体的体对角线的![]() ,故As原子到B原子最近距离
,故As原子到B原子最近距离![]() ;由晶体的密度的计算公式可得,
;由晶体的密度的计算公式可得,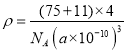 。
。

 备战中考寒假系列答案
备战中考寒假系列答案